ตัวรับความรู้สึกเจ็บปวด
| โนซิเซ็ปเตอร์ (Nociceptor) | |
|---|---|
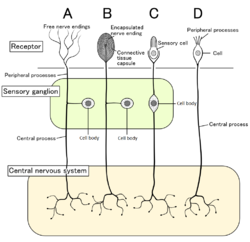 เซลล์ประสาทรับความรู้สึก 4 อย่างพร้อมกับตัวรับความรู้สึกที่คู่กัน โนซิเซ็ปเตอร์เป็นปลายประสาทอิสระที่แสดงเป็นแบบ A | |
| ตัวระบุ | |
| MeSH | D009619 |
| อภิธานศัพท์กายวิภาคศาสตร์ | |
โนซิเซ็ปเตอร์ (อังกฤษ: nociceptor มาจาก nocere แปลว่า "ทำให้เจ็บ"[1]) เป็นปลายประสาทอิสระของเซลล์ประสาทรับความรู้สึกที่ตอบสนองโดยเฉพาะต่อตัวกระตุ้นที่อาจจะทำความเสียหายต่อร่างกาย/เนื้อเยื่อ โดยส่งสัญญาณประสาทไปยังระบบประสาทกลางผ่านไขสันหลังหรือก้านสมอง กระบวนการเช่นนี้เรียกว่า โนซิเซ็ปชั่น และโดยปกติก็จะก่อให้เกิดความเจ็บปวด โนซิเซ็ปเตอร์มีอยู่ทั่วร่างกายอย่างไม่เท่ากันโดยเฉพาะส่วนผิว ๆ ที่เสี่ยงเสียหายมากที่สุด และไวต่อตัวกระตุ้นระดับต่าง ๆ กัน บางส่วนไวต่อตัวกระตุ้นที่ทำอันตรายให้แล้ว บางส่วนตอบสนองต่อสิ่งเร้าก่อนที่ความเสียหายจะเกิด ตัวกระตุ้นอันตรายดังที่ว่าอาจเป็นแรงกระทบ/แรงกลที่ผิวหนัง อุณหภูมิที่ร้อนเย็นเกิน สารที่ระคายเคือง สารที่เซลล์ในร่างกายหลั่งตอบสนองต่อการอักเสบ เป็นต้น[2][3]
ความรู้สึกเจ็บปวดไม่ได้ขึ้นอยู่กับสัญญาณที่โนซิเซ็ปเตอร์ส่งเท่านั้น แต่เป็นผลของการประมวลผลความรู้สึกต่าง ๆ อย่างซับซ้อนในระบบประสาทกลาง ที่ได้รับอิทธิพลจากอารมณ์และสิ่งแวดล้อม รวมทั้งสถานการณ์ที่เกิดสิ่งเร้าและประสบการณ์ชีวิต แม้แต่สิ่งเร้าเดียวกันก็สามารถทำให้เกิดความรู้สึกต่าง ๆ กันในบุคคลเดียวกัน ทหารที่บาดเจ็บในสนามรบอาจไม่รู้สึกเจ็บเลยจนกระทั่งไปถึงสถานพยาบาลแล้ว นักกีฬาที่บาดเจ็บอาจไม่รู้ตัวจนกระทั่งการแข่งขันจบแล้ว ดังนั้น ความรู้สึกเจ็บปวดจึงเป็นประสบการณ์ที่เป็นอัตวิสัย[4][5]
ประวัติ
[แก้]ชาลส์ สก็อตต์ เชอร์ริงตัน ค้นพบโนซิเซ็ปเตอร์ในปี ค.ศ. 1906 แม้ว่าในศตวรรษก่อนหน้านั้น นักวิทยาศาสตร์จะได้เชื่อกันว่า สัตว์เป็นเหมือนกับเครื่องกลที่เปลี่ยนพลังงานของตัวกระตุ้นความรู้สึก ไปเป็นปฏิกิริยาคือการเคลื่อนไหว เชอร์ริงตันได้ใช้วิธีการทดลองต่าง ๆ มากมาย เพื่อจะแสดงว่า การเร้าลานรับสัญญาณของเซลล์ประสาทรับความรู้สึกด้วยตัวกระตุ้นประเภทต่าง ๆ กัน จะทำให้เกิดปฏิกิริยาที่ต่างกัน สิ่งเร้าที่รุนแรงบางอย่างจะก่อให้เกิดรีเฟล็กซ์อัตโนมัติและความเจ็บปวด และตัวรับความรู้สึกเฉพาะต่อตัวกระตุ้นรุนแรงเหล่านี้แหละเรียกว่า โนซิเซ็ปเตอร์[6]
ตำแหน่งที่อยู่
[แก้]ในสัตว์เลี้ยงลูกด้วยนม โนซิเซ็ปเตอร์เป็นเซลล์ประสาทรับความรู้สึกที่ไหนก็ได้ของร่างกาย ที่สามารถรู้ความเจ็บปวดไม่ว่าจะเป็นภายนอกภายใน ตัวอย่างเซลล์ภายนอกได้แก่เนื้อเยื่อที่ผิวหนัง (โนซิเซ็ปเตอร์ที่หนัง) กระจกตา และเยื่อเมือก ส่วนตัวอย่างเซลล์ภายในอยู่ในอวัยวะหลายอย่าง เช่นกล้ามเนื้อ ข้อต่อ กระเพาะปัสสาวะ ทางเดินอาหาร และเซลล์ต่าง ๆ ตามทางย่อยอาหาร[7] โนซิเซ็ปเตอร์มีอยู่ทั่วร่างกายรวมทั้งอวัยวะภายในเกือบทั้งหมด แต่หนาแน่นเป็นพิเศษที่ผิวหนังและเยื่อเมือก และไม่มีในสมอง (แต่มีในเยื่อหุ้มสมอง)[8] หรือเนื้อแท้ (parenchyma) ของปอดและของตับ[9] ตัวของเซลล์ประสาทเหล่านี้อยู่ที่ปมประสาทรากหลัง (dorsal root ganglia) หรือ ปมประสาทไทรเจมินัล (trigeminal ganglia)[10] โดยปมประสาทไทรเจมินัลจะเป็นปมประสาทเฉพาะพิเศษของใบหน้า เปรียบเทียบกับปมประสาทรากหลัง ซึ่งเกี่ยวข้องกับร่างกายที่เหลือทั้งหมด แอกซอนของปมประสาทเหล่านั้น จะวิ่งไปจนถึงระบบประสาทส่วนปลาย และจบลงด้วยการแตกออกเป็นสาขาต่าง ๆ เพื่อเป็นลานรับสัญญาณรับความรู้สึก
พัฒนาการ
[แก้]ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ประเภทและการทำงาน
[แก้]ปลายสุดของโนซิเซ็ปเตอร์ที่พัฒนาเต็มที่แล้วในระบบประสาทส่วนปลาย จะเป็นส่วนที่ตรวจจับตัวกระตุ้นอันตราย (noxious stimuli) แล้วถ่ายโอนให้เป็นพลังงานไฟฟ้า[11] ซึ่งเมื่อถึงขีดเริ่มเปลี่ยน ก็จะมีการสร้างศักยะงานเพื่อส่งไปยังระบบประสาทกลาง นี่ก็จะนำไปสู่กระบวนการตามลำดับขั้นที่ยังให้รู้สึกเจ็บได้ นั่นก็คือ โนซิเซ็ปเตอร์จะตอบสนองต่อตัวกระตุ้นทางเคมี ทางอุณหภูมิ หรือทางแรงกลที่เฉพาะเจาะจงและที่ถึงระดับขีดเริ่มเปลี่ยนเท่านั้น โดยการยิงศักยะงานไปทางไขสันหลังหรือก้านสมอง
โนซิเซ็ปเตอร์โดยทั่ว ๆ ไปสามารถจัดประเภทหลัก ๆ เป็น 4 ประเภท คือ ที่ไวอุณหภูมิ ที่ไวแรงกล ที่ไวสิ่งเร้าหลายแบบ (polymodal) และอีกประเภทที่เข้าใจน้อยกว่าก็คือ โนซิเซ็ปเตอร์แฝง (silent nociceptor)[12]
- โนซิเซ็ปเตอร์ไวอุณหภูมิตอบสนองต่ออุณหภูมิเย็นหรือร้อนมาก คือ น้อยกว่า 5 องศาเซลเซียส (°C) หรือมากกว่า 45 °C มีใยประสาทเป็นแบบ Aδ ที่มีปลอกไมอีลินบาง
- โนซิเซ็ปเตอร์ไวแรงกลตอบสนองต่อแรงกลที่รุนแรง เป็นใยประสาทแบบ Aδ เช่นกัน
- โนซิเซ็ปเตอร์ไวสิ่งเร้าหลายแบบ (polymodal) ไวต่อแรงกลที่รุนแรง ไวสารเคมี และไวอุณหภูมิทั้งที่ร้อนและเย็นมาก เป็นใยประสาทแบบ C ที่ไร้ปลอกไมอีลิน
- โนซิเซ็ปเตอร์แฝง (silent) พบในอวัยวะภายใน (viscera) ไม่ตอบสนองต่อสิ่งเร้าของโนซิเซ็ปเตอร์ดังที่กล่าวมาแล้ว แต่การอักเสบและสารเคมีต่าง ๆ จะลดระดับขีดเริ่มเปลี่ยนที่ทำให้โนซิเซ็ปเตอร์เริ่มส่งศักยะงาน การทำงานของมันเชื่อว่ามีส่วนต่อภาวะรู้สึกเจ็บมากกว่าปกติทุติยภูมิ (secondary hyperalgesia) และการไวเจ็บเหตุประสาทส่วนกลาง (central sensitization)
หรืออีกอย่างหนึ่ง อาจจัดรูปแบบโนซิเซ็ปเตอร์เป็น 3 ประเภท คือ[1][3]
- โนซิเซ็ปเตอร์ไวแรงกลที่มีใยประสาทแบบ Aδ
- โนซิเซ็ปเตอร์ไวแรงกลและอุณหภูมิที่มีใยประสาทแบบ Aδ
- โนซิเซ็ปเตอร์ไวสิ่งเร้าหลายแบบ (polymodal) มีใยประสาทแบบ C
โนซิเซ็ปเตอร์มีแอกซอนสองแบบ แบบแรกคือแบบเอ-เด็ลตา (A delta fiber) ซึ่งเป็นแอกซอนมีปลอกไมอีลิน ที่ยิงศักยะงานไปด้วยความเร็วประมาณ 5-30 เมตรต่อวินาทีไปยังระบบประสาทกลาง อีกแบบหนึ่งเป็นแบบซี (C fiber) ซึ่งไม่มีปลอกไมอีลิน จึงส่งสัญญาณได้ช้ากว่าด้วยความเร็วประมาณ 2 เมตรต่อวินาที ผลของการมีแอกซอนสองแบบก็คือ ความเจ็บปวดเกิดขึ้นเป็นสองระยะ ระยะแรกสื่อโดยแอกซอนแบบเอ-เด็ลตาที่รวดเร็ว และระยะที่สองสื่อโดยแอกซอนแบบซีที่ช้ากว่า ความเจ็บปวดที่สัมพันธ์กับแอกซอนแบบเอ-เด็ลตาเป็นความเจ็บปวดเบื้องต้นที่เจ็บเร็วแต่ไม่คงอยู่นาน ส่วนที่สัมพันธ์กับแอกซอนแบบซีเป็นความรู้สึกที่ยาวนานกว่า และบ่งจุดที่เจ็บได้ชัดเจนน้อยกว่า (diffuse)[1]
การถ่ายโอนความรู้สึก
[แก้]เมื่อโนซิเซ็ปเตอร์ได้สิ่งเร้าที่เหมาะสม ไม่ว่าจะเป็นแรงกล อุณหภูมิ หรือสารเคมีที่เป็นอันตราย ช่องไอออนที่เยื่อหุ้มปลายก็จะถ่ายโอนสิ่งเร้านั้นเป็นกระแสไฟฟ้าที่ลดขั้วเซลล์ ซึ่งเมื่อถึงจุดเริ่มเปลี่ยนก็จะเกิดศักยะงานส่งตามแอกซอนไปทางระบบประสาทกลางไม่ว่าจะผ่านไขสันหลังหรือก้านสมอง แม้ว่าช่องไอออนที่ตอบสนองต่อสิ่งเร้าต่าง ๆ และการทำงานของพวกมันจะยังไม่ชัดเจนทั้งหมด แต่งานศึกษาเมื่อไม่นานก็ได้เพิ่มความเข้าใจเกี่ยวกับช่องไอออนที่มีการแสดงออกในโนซิเซ็ปเตอร์ ซึ่งอำนวยให้เซลล์ตอบสนองต่อสิ่งเร้ารวมทั้ง[12]
- ช่องไอออน TRPV1 ในตระกูล TRP (ดูรายละเอียดเพิ่มในหัวข้อ "ประเภทรับรู้อุณหภูมิ") อำนวยให้รู้ความร้อนแสบเนื่องกับสารแคปไซซิน (จากพริก) สารเคมีที่ทำให้เจ็บแสบอื่น ๆ และความร้อนเกินขีด ซึ่งแสดงนัยว่าเป็นช่องไอออนที่ถ่ายโอนสิ่งเร้าไปเป็นความรู้สึกร้อนแสบ
- ช่องไอออน TRPV2 ที่รับรู้อุณหภูมิระดับสูง พบในใยประสาทแบบ Aδ และช่อง TRPM8 ที่รับรู้ความเย็นจัด ทั้งสองอยู่ในตระกูล TRP เช่นกัน
- ช่อง SCN9A หรือ Nav1.7 ในตระกูล tetradotoxin-resistent Na+ channel มีบทบาทสำคัญต่อการรับรู้ความเจ็บปวด เพราะว่า ผู้ที่ยีนกลายพันธุ์จะมีความบกพร่องไม่ว่าจะไม่สามารถรู้สึกเจ็บปวด หรือมีความเจ็บปวดอย่างรุนแรงในส่วนต่าง ๆ ของร่างกาย
- ช่อง PTX8 ในตระกูล ionotropic purinergic receptor มีสิ่งเร้าเป็น ATP ที่หลั่งออกจากเซลล์รอบ ๆ เนื้อเยื่อที่เสียหาย
- ช่องไอออนในตระกูล Mas-related G protein-coupled receptor (Mrg) ที่มีสิ่งเร้าเป็นลิแกนด์แบบเพปไทด์ ซึ่งทำให้โนซิเซ็ปเตอร์ไวต่อสารเคมีต่าง ๆ ที่อยู่รอบ ๆ
ประเภทรับรู้อุณหภูมิ
[แก้]โนซิเซ็ปเตอร์รับอุณหภูมิจะเริ่มทำงานเมื่อได้สิ่งเร้าที่เป็นความร้อนอันตรายหรือความเย็นอันตราย ในระดับอุณหภูมิต่าง ๆ โนซิเซ็ปเตอร์จะถ่ายโอนพลังงานความเย็นร้อนไปเป็นสัญญาณประสาทอาศัยช่องไอออนต่าง ๆ ที่ไม่เหมือนกัน
งานวิจัยปี 2544[13] พบว่าความร้อนเย็นจะกระตุ้นช่องไอออนกลุ่ม TRP (Transient potential receptor) ซึ่งให้แคตไอออนซึมผ่านได้อย่างไม่เลือก (รวมทั้งแคลเซียมและแมกนีเซียม[14]) และมีโครงสร้างคล้ายกับช่องที่เปิดปิดด้วยศักย์ไฟฟ้า (voltage-gated channel) โดยช่อง TRP แต่ละอย่างจะไวความเย็นร้อนต่าง ๆ กัน คือ เมื่อถึงขีดเริ่มเปลี่ยนทางอุณหภูมิ ช่องก็จะเปิดให้แคตไอออนไหลผ่านเข้ามากขึ้น[13]
| ช่องไอออน | อุณหภูมิ (°C) | สาร/เคมี | หมายเหตุ |
|---|---|---|---|
| TRPA1 | <17 | กระเทียม (allicin), ผักกาด (allyl isothiocyanate), icilin[16],
ขิง (gingerol), cinnamic aldehyde, เมทิลซาลิไซเลต, ยูเจนอล (น้ำมันกานพลู)[17] |
พบในปลายประสาทรับเย็นที่มีขีดเริ่มเปลี่ยนสูง |
| TRPM8 | 8-28 | เมนทอล, พืชวงศ์กะเพรา (กะเพรา โหระพา แมงลักเป็นต้น), icilin[16] | พบในปลายประสาทรับเย็นทั้งมีขีดเริ่มเปลี่ยนสูงและต่ำ |
| TRPV4 | >27 | cytochrome P450 metabolites of arachidonic acid, 4α-phorboldibutyryl didecanoate[18] | รับรู้สัมผัส/แรงกล |
| TRPV3 | >31/39 | การบูร, 2-aminoethoxydiphenyl borate (2-APB)[18] | พบในปลายประสาทรับร้อน |
| TRPV1 | >43 | แคปไซซิน (จากพริก), สารประกอบ vanilloid, โปรตอน (กรด), anandamide, N-arachi-donyl dopamine, 12-HPETE, เอทานอล, การบูร, 2-APB[18],
resiniferatoxin[16] |
พบในโนซิเซ็ปเตอร์รับร้อนทั้งแบบ Aδ และ C[19] |
| TRPV2 | >52 | 2-APB[18] | พบในโนซิเซ็ปเตอร์รับร้อนแบบ Aδ[19] ทำให้รู้สึกร้อนลวก |
กลไกการทำงานของช่องไอออนเหล่านี้ยังไม่ชัดเจน รวมทั้ง
- ยังไม่ชัดเจนว่า ความร้อนเย็นเปิดปิดช่องเหล่านี้ได้อย่างไร
- ถึงแม้จะรู้ว่า ช่องไอออนแต่ละอย่างเหล่านี้ไวอุณหภูมิในช่วงไหน แต่ก็ยังไม่รู้กระบวนการทำงานร่วมกันของช่องเหล่านี้ และกระบวนการที่ตัดสินว่าอุณหภูมิหนึ่ง ๆ มีระดับเกินขีดริ่มเปลี่ยนของโนซิเซ็ปเตอร์ได้อย่างไร
- แม้จะได้ระบุช่องไอออน TRPV1 และ TRPV2 ในโนซิเซ็ปเตอร์รับร้อนแล้ว และได้พบ TRPA1 และ TRPM8 ในปลายประสาทรับเย็น (ที่ไม่ใช่เป็นโนซิเซ็ปเตอร์) ถึงอย่างนั้น เราก็ยังไม่รู้ว่าช่อง TRP มีบทบาทในการตรวจจับความเย็นจัดในโนซิเซ็ปเตอร์รับเย็นหรือไม่
การค้นพบที่น่าสนใจอีกอย่างหนึ่งเกี่ยวกับการตอบสนองของร่างกายต่อตัวกระตุ้นเย็นก็คือ ถึงแม้ว่า ความไวของเซลล์รับสัมผัสและเซลล์ประสาทสั่งการเคลื่อนไหว จะลดสมรรถภาพไปเมื่อประสบกับตัวกระตุ้นเย็น แต่ว่า การรู้สึกความเจ็บปวดที่เบื้องต้นสื่อโดยโนซิเซ็ปเตอร์นั้น ยังดำรงสมรรถภาพอยู่
ประเภทเชิงกล
[แก้]โนซิเซ็ปเตอร์เชิงกลรับรู้แรงกดดันหรือความแปรรูปของเนื้อเยื่อที่เกินพิกัด และการกระทบที่ทะลุผ่านผิวหนัง เปลือกสมองจะประมวลผลปฏิริยาต่อตัวกระตุ้นเช่นนั้นและอาจให้ผลเป็นความเจ็บปวด (ซึ่งเหมือนกับสิ่งเร้าเชิงเคมีหรือเชิงอุณหภูมิ) โนซิเซ็บเตอร์เดียวกันบ่อยครั้งสามารถตอบสนองต่อตัวกระตุ้นหลายประเภท ดังนั้น จึงเป็นไปได้ที่ช่องไอออนซึ่งต่อสนองต่ออุณหภูมิ จะตอบสนองต่อแรงกลด้วย โดยโนซิเซ็บเตอร์เชิงเคมีก็มีนัยเหมือนกัน เพราะช่อง TRPV4 ดูเหมือนจะตรวจจับความเปลี่ยนแปลงทั้งเชิงกลทั้งเชิงอุณหภูมิ
ประเภทเชิงเคมี
[แก้]โนซิเซ็ปเตอร์เชิงเคมีมีช่องทีอาร์พี[A] ที่ตอบสนองต่อเครื่องเทศหลายอย่างหลายชนิดที่ใช้ในการปรุงอาหาร เครื่องเทศที่ก่อให้เกิดปฏิกิริยาตอบสนองระดับสูง และที่มีการศึกษาวิจัยกันมากที่สุดก็คือ แคปไซซิน ตัวกระตุ้นเชิงเคมีบางอย่างเป็นสารระคายเคือง เป็นต้นว่า อะโครลีน ที่เป็นอาวุธเคมีในสงครามโลกครั้งที่หนึ่ง และเป็นองค์ประกอบอย่างหนึ่งในควันบุหรี่
นอกจากตัวกระตุ้นภายนอกเหล่านี้แล้ว โนซิเซ็ปเตอร์เชิงเคมีมีความสามารถในการตรวจจับลิแกนด์ภายใน และกรดไขมันอะมีน[B] เหมือนกับในโนซิเซ็บเตอร์รับอุณหภูมิ โนซิเซ็ปเตอร์เชิงเคมีมีช่องทีอาร์พีวี 1 ที่สามารถตรวจจับสารเคมีอย่างเช่นแคปไซซินและพิษแมงมุม[20]
ประเภทมีปฏิกิริยาหลายแบบ
[แก้]มีโนซิเซ็ปเตอร์จำนวนมากที่ตอบสนองต่อตัวกระตุ้นเพียงแค่อย่างเดียว ดังนั้น โนซิเซ็ปเตอร์ที่สามารถทำงานได้หลายหน้าที่จึงจัดอยู่ในพวก โนซิเซ็ปเตอร์ไวสิ่งเร้าหลายแบบ (polymodal nociceptor) ที่มีปฏิกิริยาหลายแบบ[21]
วิถีประสาท
[แก้]- ดูเทียบกับวิถีประสาทของระบบรับความรู้สึกทางกาย
วิถีประสาทรับความรู้สึกทางกายที่ตัวรับความรู้สึกส่งสัญญาณไปยังระบบประสาทกลาง โดยปกติจะมีนิวรอนส่งสัญญาณต่อ ๆ กันยาว 3 ตัว[22] คือปฐมภูมิ (primary) ทุติยภูมิ (secondary) และตติยภูมิ (tertiary) หรือ first order, second order, และ third order[23]
- first order neuron จะมีตัวเซลล์อยู่ที่ปมประสาทรากหลัง (dorsal root ganglion) ที่ไขสันหลัง แต่ถ้าเป็นความรู้สึกที่ศีรษะหรือคอซึ่งเส้นประสาทไขสันหลังที่คอ (cervical nerve) ไม่มีส่วนเกี่ยวข้อง ตัวเซลล์ก็จะอยู่ที่ปมประสาท trigeminal หรือปมประสาทของเส้นประสาทสมอง (cranial nerve) เส้นอื่น ๆ แอกซอนของเซลล์จะส่งสัญญาณไปยัง second order neuron ในซีกร่างกายเดียวกัน
- second order neuron จะมีตัวนิวรอนในซีกร่างกายเดียวกันกับ first order neuron โดยถ้าไม่อยู่ในไขสันหลังก็ในก้านสมอง โดยแอกซอนของนิวรอนอาจจะวิ่งขึ้น/ลงแล้วข้ามไขว้ทแยง (decussate) ไปด้านตรงข้ามถ้าไม่ในไขสันหลังก็ในก้านสมอง และแอกซอนส่วนหนึ่งก็จะไปสุดที่ทาลามัสส่วนต่าง ๆ เช่น ในส่วน ventral posterior nucleus (VPN) ในขณะที่ส่วนที่เหลือก็จะไปสุดที่ reticular activating system (หรือเรียกว่า reticular system) หรือที่สมองน้อย
- ในการรับรู้เหนือจิตสำนึกทางสัมผัส อากัปกิริยา และความรู้สึกที่อาจก่อให้เกิดความเจ็บปวดบางประเภท third order neuron จะมีตัวเซลล์ในทาลามัสส่วน VPN และส่งสัญญาณไปสุดที่คอร์เทกซ์รับความรู้สึกทางกาย (somatosensory cortex/postcentral gyrus) ของสมองกลีบข้าง
สำหรับความรู้สึกจากกายยกเว้นใบหน้า ใยประสาทนำเข้าของโนซิเซ็ปเตอร์ซึ่งเป็น first order neuron จะเดินทางเข้าไปสุดเป็นไซแนปส์ที่ปีกหลังของไขสันหลัง (dorsal horn) เชื่อมกับ second order neuron ซึ่งอยู่ที่ปีกหลังโดยแบ่งกลุ่มออกเป็นชั้นต่าง ๆ ที่เรียกว่า ลามีเน (laminae) ใยประสาทที่ส่งความรู้สึกประเภทต่าง ๆ จากร่างกายปกติจะใช้กลูตาเมตเป็นสารสื่อประสาทหลัก โดยใยที่ไม่ได้หุ้มปลอกไมอีลิน (คือกลุ่ม C) บางครั้งจะปล่อยสารสื่อประสาทร่วมเป็น neuropeptide รวมทั้ง substance P, CGRP, somatostatin, และ gelanin เป็นต้น ใยประสาทแบบซีไปสุดที่นิวรอนในชั้น 1 และ 2 ส่วนใยประสาทแบบเอ-เด็ลตาไปสุดที่นิวรอนในชั้น 1, 2 และ 5[10][C]
วิถีประสาทซึ่งส่งข้อมูลจากโนซิเซ็ปเตอร์ไปยังศูนย์ประมวลผลต่าง ๆ ในสมองรวมทั้งทาลามัส เปลือกสมอง และสมองน้อย รวมทั้ง[25]
- Trigeminothalamic tract ส่งข้อมูลเกี่ยวกับความเจ็บปวดที่มาจากศีรษะส่วนหน้ารวมทั้งใบหน้า ไปยังทาลามัส แล้วต่อไปยังคอร์เทกซ์รับความรู้สึกทางกายเป็นต้น โดย first order neuron อยู่ที่ปมประสาทของเส้นประสาทสมอง (รวมทั้ง trigeminal [V], facial [VII], glossopharyngeal [IX], และ vagus [X]) ซึ่งส่งแอกซอนไปยัง second order neuron ในซีกร่างกายเดียวกันที่ Trigeminal nuclei[26] ซึงก็ส่งแอกซอนข้ามไขว้ทแยงที่ก้านสมอง (medulla[27]) ไปสุดที่ทาลามัสส่วน ventral posterior medial nucleus (VPM)[27] เพื่อการรับรู้และจำแนก และไปสุดที่ส่วนอื่น ๆ ซึ่งมีหน้าที่เกี่ยวกับอารมณ์-แรงจูงใจรวมทั้ง midline thalamic nuclei[D], reticular formation, superior colliculus, periaquiductal grey, ไฮโปทาลามัส, และอะมิกดะลา[E]ส่วน third order neuron ในทาลามัสก็จะส่งแอกซอนไปที่คอร์เทกซ์รับความรู้สึกทางกาย (somatosensory cortex/postcentral gyrus), anterior cingulate cortex, และ insular cortex[30]
- anterolateral system/spinothalamic tract ส่งข้อมูลเกี่ยวกับความเจ็บปวดจากร่างกายรวมศีรษะครึ่งหลัง ผ่านไขสันหลังไปยังทาลามัส แล้วต่อไปยังคอร์เทกซ์รับความรู้สึกทางกายเป็นต้น โดย first order neuron อยู่ที่ปมประสาทรากหลัง ซึ่งส่งแอกซอนขึ้น/ลงผ่าน Lissauer's tract 1-2 ข้อไขสันหลังไปยัง second order neuron ในปีกหลังของไขสันหลัง (dorsal horn) ในซีกร่างกายเดียวกันแต่อยู่ต่างระดับไขสันหลังกัน second order neuron ก็จะส่งแอกซอนข้ามไขว้ทแยงที่ไขสันหลังแล้วขึ้นไปตาม anterolateral column/spinothalamic tract ไปยังทาลามัสส่วน ventral posteriorlateral nucleus (VPL) เพื่อการรับรู้และจำแนก และไปสุดที่ส่วนอื่น ๆ ซึ่งมีหน้าที่เกี่ยวกับอารมณ์-แรงจูงใจรวมทั้ง midline thalamic nuclei[D], reticular formation, superior colliculus, periaquiductal grey, ไฮโปทาลามัส, และอะมิกดะลา[E] ส่วน third order neuron ในทาลามัสก็จะส่งแอกซอนไปที่คอร์เทกซ์รับความรู้สึกทางกาย (somatosensory cortex/postcentral gyrus), anterior cingulate cortex, และ insular cortex[31]
ภาวะรู้สึกเจ็บมากกว่าปรกติ
[แก้]ภาวะรู้สึกเจ็บมากกว่าปรกติ (hyperalgesia) เป็นภาวะที่เกิดขึ้นหลังจากเนื้อเยื่อเสียหาย ไม่ว่าจะเป็นการบาด ถลอก หรือชอกช้ำเป็นต้น แล้วมีผลทำให้สิ่งเร้าที่ปกติจะรู้สึกเจ็บเพียงเล็กน้อย จะเจ็บมากขึ้น เช่น ผิวหนังที่ไหม้แดดจะไวเจ็บต่อความอุ่นร้อนมากขึ้น เป็นภาวะที่อาศัยความไวสิ่งเร้าที่เปลี่ยนไปทั้งของโนซิเซ็ปเตอร์ตรงปลาย (peripheral) หรือ/และนิวรอนในระบบประสาทกลาง[32]
ความไวสิ่งเร้า (sensitization) ของโนซิเซ็ปเตอร์
[แก้]ความไวสิ่งเร้าของโนซิเซ็ปเตอร์สามารถเปลี่ยนไปอาศัยปัจจัยต่าง ๆ มากมาย[33] รวมทั้งการหลั่งสารเคมีต่าง ๆ ของเซลล์รอบ ๆ เนื้อเยื่อที่เสียหาย โดยสารบางอย่างจะมาจากเซลล์โดยเฉพาะ ๆ ซึ่งร่วมกันจะลดขีดเริ่มเปลี่ยนการตอบสนองของโนซิเซ็ปเตอร์ สารเคมีรวมทั้ง[34][32][35]
- เพปไทด์และโปรตีน
- bradykinin เป็นสารก่อความเจ็บปวดที่แรงที่สุดอย่างหนึ่ง เพราะทำให้โนซิเซ็ปเตอร์ทั้งแบบ Aδ และ C ตอบสนองโดยตรง มีฤทธิ์เพิ่มการทำงานของ TRPV1 ผ่านหน่วยรับความรู้สึก bradykinin ที่โนซิเซ็ปเตอร์ และยังเพิ่มการสังเคราะห์และปล่อยโพรสตาแกลนดินของเซลล์ที่อยู่ใกล้ ๆ
- substance P เป็นเพปไทด์ในสกุล neurokinin เป็นสารที่ปลายประสาทโนซิเซ็ปเตอร์เองปล่อยด้วย โดยมีผลดังที่จะกล่าวต่อไป
- nerve growth factor (NGF) เป็น neurotrophin และทำให้เจ็บ มีฤทธิ์เป็นพิเศษในเขตอักเสบ เพราะเซลล์รอบ ๆ ส่วนที่อักเสบจะผลิต NGF มากขึ้น ซึ่งจะเข้ายึดกับ IrkA receptor ที่ปลายประสาทโนซิเซ็ปเตอร์ แล้วเพิ่มการแสดงออกของช่องไอออน ซึ่งทำให้กระตุ้นโนซิเซ็ปเตอร์ได้ง่ายขึ้น และทำให้มีการขนส่งเอนโดโซมสำหรับส่งสัญญาณจากปลายโนซิเซ็ปเตอร์ย้อนทางไปทางตัวเซลล์ มีผลให้เซลล์สังเคราะห์ BDNF (brain derived neurotrophic factor) มากขึ้นแล้วปล่อยออกที่ปลายประสาทในปีกหลังของไขสันหลัง ซึ่งทำให้นิวรอนในปีกหลังกระตุ้นได้ง่ายขึ้นอีกด้วย
- anandamide ซึ่งเป็น canabinoid agonist ที่ร่างกายผลิตเอง และปล่อยออกเมื่อมีการอักเสบ มีฤทธิ์ให้ช่องไอออน TRPV1 ทำงาน และอาจทำให้เจ็บ
- Cytokine รวมทั้ง interleukin-1 (IL-1) และ TNF (tumor necrosis factor) ซึ่งเซลล์รอบ ๆ ผลิตและปล่อยมากขึ้นเนื่องจากความบาดเจ็บ ทำให้เซลล์หลายประเภทสังเคราะห์และปล่อย NGF มากขึ้น
- อะตอม/โมเลกุลอื่น ๆ รวมทั้ง
- ฮิสตามีน จาก mast cell หลังจากเนื้อเยื่อเสียหาย และทำให้โนซิเซ็ปเตอร์ที่ไวสิ่งเร้าหลายแบบตอบสนอง
- ATP, เซโรโทนิน, Acetylcholine - ปล่อยโดยเซลล์บุโพรง (endothelial cells) เช่นเยื่อบุเส้นเลือด และเกล็ดเลือดที่เสียหาย ทำให้โนซิเซ็ปเตอร์ไวสิ่งเร้ามากขึ้นโดยอ้อม เพราะกระตุ้นให้เซลล์รอบ ๆ ปล่อยโพรสตาแกลนดินและ bradykinin
- โพรสตาแกลนดิน - ปล่อยจากเซลล์ที่เสียหาย, มีส่วนทำให้หลอดเลือดขยาย, เชื่อว่าเข้ายึดกับ G-protein-coupled receptor ที่เพิ่ม second messenger ในโนซิเซ็ปเตอร์ คือ cyclic AMP ซึ่งสำคัญในกระบวนการต่าง ๆ , ลดขีดเริ่มเปลี่ยนของการลดขั้วในการสร้างศักยะงานเนื่องกับงช่องไอออนบางชนิด (tetrodotoxin-resistent sodium channels) ที่พบในโนซิเซ็ปเตอร์, สังเคราะห์อาศัยเอนไซม์ cyclooxygenase (COX) ซึ่งเริ่มทำงานเมื่อมีการอักเสบ (inflammation) ยาที่ระงับการทำงานของ COX รวมทั้ง แอสไพรินและ NSAID จึงมีผลลดปวดและการอักเสบ
- Leukotriene เป็นสารอำนวยให้เกิดการอักเสบผลิตโดยเม็ดเลือดขาว มักจะผลิตร่วมกับฮิสตามีนและโพรสตาแกลนดิน
- โปรตอนนอกเซลล์ และเมแทบอไลต์ที่เป็นลิพิด เพิ่มการตอบสนองต่อความร้อนของช่องไอออน TRPV1
- arachidonic acid เป็นสารมัธยันตร์หลักอย่างหนึ่งของกระบวนการอักเสบ และมีฤทธิ์ขยายหลอดเลือด[36]
- ไนตริกออกไซด์
นอกจากนั้น ความเสียหายต่อเนื้อเยื่อซึ่งมีผลให้เซลล์รอบ ๆ ปล่อย bradykinin และโพรสตาแกลนดิน ยังมีผลให้ปลายประสาทโนซิเซ็ปเตอร์ด้านนอก (peripheral terminal) เอง ปล่อย substance P และ CGRP (Calcitonin gene-related peptide) โดย CGRP จะทำให้เส้นเลือดรอบ ๆ ขยาย และ substance P จะทำให้เนื้อเยื่อรอบ ๆ บวมเพราะการรั่วพลาสมาจากหลอดเลือด (plasma extravasation) ซึ่งเป็นกระบวนการที่ทำให้โปรตีน เซลล์ และน้ำไหลออกจากหลอดเลือดดำเล็กได้ ความบวมน้ำที่เพิ่มขึ้นก็จะทำให้เซลล์รอบ ๆ ปล่อย bradykinin เพิ่มขึ้น นอกจากนั้น substance P ยังมีผลทำให้ mast cell ใกล้ ๆ ปล่อยฮิสตามีน (และ NGF) ซึ่งก็ทำให้โนซิเซ็ปเตอร์ (รวมทั้งตัวอื่นที่อยู่ใกล้ ๆ) ตอบสนองอีก กระบวนการเช่นนี้ทำให้มีอาการต่าง ๆ จากการอักเสบรวมทั้งเนื้อเยื่อร้อน (calor) แดง และบวม เป็นกระบวนการที่เรียกว่า neurogenic inflammation (การอักเสบที่เกิดจากประสาท) เพราะอาศัยการปล่อยสารของปลายประสาทจึงเกิดขึ้นได้[34]
การเพิ่มความไวสิ่งเร้าในเขตประสาทส่วนปลาย เป็นตัวอย่างแสดงสภาพพลาสติก (คือความยืดหยุ่นได้) ของโนซิเซ็ปเตอร์ คือ โนซิเซ็ปเตอร์สามารถเปลี่ยนจากการเป็นตัวตรวจจับตัวกระตุ้นอันตราย ไปเป็นตัวตรวจจับตัวกระตุ้นไม่อันตราย ผลของความเปลี่ยนแปลงเช่นนี้ก็คือ ตัวกระตุ้นที่อยู่ในระดับต่ำที่ไม่เป็นอันตราย อาจจะก่อให้เกิดความรู้สึกเจ็บปวด นี่เป็นสภาวะที่เรียกว่า ภาวะรู้สึกเจ็บมากกว่าปรกติ (hyperalgesia) การอักเสบเป็นเหตุสามัญที่ก่อให้เกิดผลเช่นนั้น และโดยปกติแล้ว ภาวะรู้สึกเจ็บมากกว่าปรกติจะหายไปเมื่อการอักเสบลดลง[37] แต่บางครั้ง แต่ความบกพร่องของยีน และ/หรือความบาดเจ็บที่ซ้ำซาก ก็สามารถก่อให้เกิดสภาวะอัลโลดีเนีย (allodynia[F]) ได้ด้วย[ต้องการอ้างอิง] ซึ่งตัวกระตุ้นที่ไม่มีอันตรายโดยประการทั้งปวงเช่นการถูกต้องอย่างเบา ๆ ก่อให้เกิดความเจ็บปวด
อัลโลดีเนียอาจมีเหตุมาจากความเสียหายของโนซิเซ็ปเตอร์ในระบบประสาทส่วนปลาย ซึ่งมีผลให้เกิดการทำงานที่ผิดปกติในระบบประสาทกลาง ด้วยกรณีอย่างนี้ แอกซอนของโนซิเซ็ปเตอร์ที่เสียหายในปีกหลังของไขสันหลัง จะยังทำการเชื่อมต่อกับไขสันหลัง ทำให้เกิดการส่งสัญญาณผิดปกติจากโนซิเซ็ปเตอร์ที่เสียหายไปยังระบบประสาทกลาง[38]
Axon reflex
[แก้]การทำงานของโนซิเซ็ปเตอร์นอกจากจะมีผลต่อโนซิเซ็ปเตอร์ที่อยู่ใกล้ ๆ กันแล้ว ใยประสาทโนซิเซ็ปเตอร์ 1 ใยอาจแตกเป็นสาขา ๆ ครอบคลุมระยะทางเป็นร้อย ๆ ไมโครเมตร ถ้าปลายที่สาขาหนึ่งได้รับสิ่งเร้า ศักยะงานที่ส่งไปทางแอกซอนอาจวิ่งย้อนทางไปที่ปลายของสาขาอื่น ๆ ซึ่งก็จะหลั่ง substance P และ CGRP ออกอีก มีผลเป็นการบวมน้ำใกล้ ๆ ปลายสาขาต่าง ๆ ของโนซิเซ็ปเตอร์คล้ายกับดังที่กล่าวมาก่อน กระบวนการนี้เรียกว่า axon reflex[39][34]
การไวเจ็บเหตุประสาทส่วนกลาง
[แก้]นอกจากภาวะรู้สึกเจ็บมากกว่าปรกติที่มีเหตุจากโนซิเซ็ปเตอร์ที่ระบบประสาทส่วนปลายแล้ว ความเจ็บอาจเพิ่มขึ้นเนื่องจากการเปลี่ยนแปลงในระบบประสาทส่วนกลางเช่นที่ปีกหลังของไขสันหลังอีกด้วย[34] เช่น ถ้าโนซิเซ็ปเตอร์ส่งสัญญาณที่ยาวนานและมีกำลังมากไปทางแอกซอนแบบซี นิวรอนที่ปีกหลังของไขสันหลัง (dorsal horn) ก็จะตอบสนองเพิ่มขึ้นเรื่อย ๆ ซึ่งทำให้ไวเจ็บขึ้น ปรากฏการณ์นี้เรียกว่า wind-up และคล้ายกับในโรคบาดทะยักที่เกิดขึ้นที่กล้ามเนื้อ[38]
ภาวะโรค
[แก้]โรคที่สัมพันธ์กับความเจ็บปวดและโนซิเซ็ปเตอร์ นอกเหนือไปจากภาวะรู้สึกเจ็บมากกว่าปรกติตามที่กล่าวไปแล้ว รวมทั้ง[12]
- Allodynia[F] - คนไข้รู้สึกเจ็บเพราะสิ่งเร้าที่ไม่เป็นอันตราย เช่น การลูบอย่างเบา ๆ ที่ผิวหนังกลับรู้สึกเหมือนกับถูกแดดเผา การเจ็บข้อต่อเหมือนกับเป็นโรคไขข้ออักเสบเป็นต้น
- ภาวะรู้สึกเจ็บมากกว่าปรกติ (hyperalgesia) - คนไข้รู้สึกเจ็บเกินต่อสิ่งเร้าที่เป็นอันตราย อาจเจ็บอย่างคงยืนแม้ไม่มีสิ่งเร้า
- Nociceptive pain - ความเจ็บปวดที่เกิดจากความเสียหายที่เนื้อเยื่อและการอักเสบ
- ความเจ็บปวดเพราะเส้นประสาท (neuropathic pain) - เกิดจากจากความเสียหายต่อเส้นประสาทหรือระบบประสาทกลาง มีโรคต่าง ๆ รวมทั้ง
- complex regional pain syndrome เป็นความเจ็บปวดที่มักแย่ลงในระยะยาว เป็นความเจ็บปวดที่มากเกินสัดส่วนเมื่อเทียบกับความบาดเจ็บที่เกิดในเบื้องต้น และมักจะมากับความไวเจ็บและความบวมของผิวหนัง
- post-herpectic neuralgia - เป็นความเจ็บปวดที่มีต่อหลังจากเป็นโรคงูสวัด (herpes zoster)
- phantom limb pain - ความเจ็บปวดที่มีตรงอวัยวะ (เช่น แขนขา) ที่ถูกตัดออกไปแล้ว
- anesthesia dolorosa - เป็นความเจ็บปวดแม้ไม่มีสิ่งเร้าใด ๆ เลย
อิทธิพลของระบบประสาทกลาง
[แก้]เปลือกสมองกับความเจ็บปวด
[แก้]คอร์เทกซ์หลัก ๆ ที่อาจได้รับข้อมูลจากโนซิเซ็ปเตอร์รวมทั้ง[40]
- คอร์เทกซ์รับความรู้สึกทางกาย (somatosensory cortex) มีลานรับสัญญาณเล็กซึ่งเข้ากับพฤติกรรมที่ระบุความเจ็บปวดอย่างเฉพาะเจาะจงได้[28]) แต่อาจไม่มีส่วนในความเจ็บปวดแบบกำหนดที่อย่างเฉพาะเจาะจงไม่ได้ซึ่งมักพบในคนไข้
- anterior cingulate cortex ตอบสนองอย่างเฉพาะเจาะจงกับตัวกระตุ้นโนซิเซ็ปเตอร์ เป็นส่วนของระบบลิมบิกที่เชื่อว่าแปลผลทางอารมณ์เกี่ยวกับความเจ็บปวด
- insular cortex ตอบสนองอย่างเฉพาะเจาะจงกับตัวกระตุ้นโนซิเซ็ปเตอร์ ได้รับแอกซอนโดยตรงจากทาลามัสโดยเฉพาะจากส่วน medial nuclei และ VPM คอร์เทกซ์นี้มีหน้าที่ประมวลผลเกี่ยวกับภาวะต่าง ๆ ภายในร่างกาย และมีส่วนในการตอบสนองของระบบประสาทอิสระต่อความเจ็บปวด คนไข้ที่มีรอยโรคที่คอร์เทกซ์นี้ ปรากฏว่า จะไม่ทุกข์ร้อนต่อความเจ็บปวด (Pain asymbolia) ข้อมูลต่าง ๆ เช่นนี้แสดงนัยว่า คอร์เทกซ์นี้เป็นแหล่งรวบรวมประมวลข้อมูลเกี่ยวกับความเจ็บปวดทั้งในด้านประสาทสัมผัส อารมณ์ และประชาน
Gate control theory
[แก้]นิวรอนในปีกหลังของไขสันหลังบางส่วนตอบสนองต่อตัวกระตุ้นอันตรายอย่างเฉพาะเจาะจง แต่ก็มีบางอย่างที่ตอบสนองต่อตัวกระตุ้นอันตรายด้วย ตัวกระตุ้นอย่างอื่นด้วย งานศึกษาปี 2508 ได้เสนอว่า การส่งข้อมูลจากตัวรับความรู้สึกอื่น ๆ อาจมีผลลดการส่งข้อมูลของโนซิเซ็ปเตอร์ นี่อธิบายเหตุการณ์ที่เมื่อตีค้อนลงที่นิ้ว การสะบัดมืออาจช่วยบรรเทาความเจ็บปวด เพราะข้อมูลที่ส่งไปจากตัวรับความรู้สึกอื่น ๆ จะระงับการส่งข้อมูลที่ทำให้เกิดความเจ็บปวด[41] คือความรู้สึกสัมผัสที่เป็นแรงกลและส่งไปตามแอกซอนขนาดใหญ่ (Aβ) สามารถยับยั้งการส่งข้อมูลของโนซิเซ็ปเตอร์ซึ่งส่งไปตามใยประสาท Aδ และ C[42]
ปรากฏการณ์นี้ต่อมาเรียกว่า Gate control theory ซึ่งใช้สร้างอุปกรณ์ที่เรียกว่า TENS (transcutaneous electrical nerve stimulation) ที่แปะอิเล็กโทรดกับส่วนร่างกายที่เจ็บ เพื่อกระตุ้นใยประสาทนำเข้าขนาดใหญ่ซึ่งช่วยระงับความเจ็บปวด[41]
วิถีประสาทควบคุมความเจ็บปวดจากสมอง
[แก้]นอกจากมีวิถีประสาทที่ส่งสัญญาณนำเข้าจากโนซิเซ็ปเตอร์ไปยังสมอง ซึ่งในที่สุดทำให้รู้สึกเจ็บ ก็ยังมีวิถีประสาทที่ส่งสัญญาณนำออกมาจากสมอง ซึ่งสามารถปรับระดับสัญญาณที่ส่งจากโนซิเซ็ปเตอร์ คือ สมองอาจปล่อยฮอร์โมนหรือสารเคมีเฉพาะอย่าง ที่มีสมรรถภาพในการระงับความปวดและสามารถลดหรือห้ามความรู้สึกเจ็บปวดได้ เขตในสมองที่ปล่อยฮอร์โมนเหล่านี้รวมเขตไฮโปทาลามัส[43]
ปรากฏการณ์การส่งสัญญาณระงับความเจ็บปวด สามารถเห็นได้โดยกระตุ้นเขตเนื้อเทารอบท่อน้ำสมอง (periaqueductal grey[G] ซึ่งได้รับแอกซอนที่ส่งมาจากไฮโปทาลามัส[44]) ในสมองส่วนกลาง ด้วยไฟฟ้า โดยเนื้อเทารอบท่อน้ำสมองก็จะส่งสัญญาณต่อ ๆ ไปในเขตสมองที่มีหน้าที่ควบคุมความรู้สึกเจ็บปวดอื่น ๆ เช่น nucleus raphes magnus (NPG) ของ rostroventral medulla[H] ซึ่งก็ส่งสัญญาณยับยั้งอาศัยเซโรโทนินไปยังนิวรอนชั้น 1-2-5 ในปีกหลังของไขสันหลัง และปรับระดับของสัญญาณโนซิเซ็ปเตอร์ที่ส่งจากไขสันหลังผ่าน spinothalamic tract ไปยังทาลามัส ซึ่งมีผลเป็นการระงับความปวด[46]
นอกจากเนื้อเทารอบท่อน้ำสมองแล้ว นิวเคลียสในพอนส์และ medulla อื่น ๆ รวมทั้ง locus ceruleus ก็ยังส่งสัญญาณอาศัย noradrenaline ไปยับยั้งนิวรอนในชั้น 1 และ 5 ของปีกหลังของไขสันหลังทั้งโดยตรงและโดยอ้อมอีกด้วย[46][H]
กลไกการทำงาน
[แก้]มนุษย์รู้จักสารเข้าฝิ่น (โอปิออยด์) ว่าเป็นยาแก้ปวดที่มีฤทธิ์แรงเป็นพัน ๆ ปีแล้ว แต่พึ่งใน 2-3 ทศวรรษที่ผ่านมา จึงได้ความชัดเจนว่า ในเรื่องระงับความปวด สารเข้าฝิ่นสัมพันธ์อย่างใกล้ชิดกับวิถีประสาทนำออกจากสมองที่ควบคุมความเจ็บปวด เช่นที่เริ่มจากเนื้อเทารอบท่อน้ำสมองเป็นต้น มีการค้นพบทั้งหน่วยรับความรู้สึก (receptor) ของเซลล์ที่สารเข้าฝิ่นสามารถออกฤทธิ์ และสารเข้าฝิ่นอื่น ๆ ที่ร่างกายผลิตเอง หน่วยรับความรู้สึกรวมทั้งแบบ μ, δ, และ κ และสารเข้าฝิ่นที่ร่างกายผลิตรวมทั้งเอ็นดอร์ฟิน, เอ็นโดมอร์ฟีน, enkephalin, และ dynorphin[47] งานศึกษาต่าง ๆ ยังแสดงด้วยว่า ผลของมอร์ฟีน (ซึ่งเป็นสารเข้าฝิ่น) ต่อสมอง รวมการส่งสัญญาณยับยั้งจากสมองไปยังนิวรอนที่ไขสันหลัง และการฉีดมอร์ฟีนเข้าที่เนื้อเทารอบท่อน้ำสมอง หรือเขตอื่นที่ควบคุมความเจ็บปวดโดยเฉพาะ ๆ รวมไขสันหลัง ก็สามารถระงับความปวดได้ด้วย[44]
นิวรอนที่ผลิตเอ็นดอร์ฟิน (β-endorphin) อยู่ในไฮโปทาลามัสและส่งแอกซอนไปสุดที่เนื้อเทารอบท่อน้ำสมองและที่อื่น ๆ ส่วนนิวรอนที่มี enkephalin และ dynorphin ในตัวเซลล์และปลายแอกซอน จะพบใน rostroventral medulla ในก้านสมองและในชั้น 1-2 ของปีกหลังของไขสันหลัง[47][I] โดยที่ปลายแอกซอนจะอยู่ใกล้กับไซแนปส์ระหว่างโนซิเซ็ปเตอร์กับ second order neuron (projection neuron) ที่ส่งสัญญาณต่อไปยังทาลามัส นอกจากนั้น หน่วยรับความรู้สึกทั้งแบบ δ และ κ ยังแสดงออกที่ปลายแอกซอนของโนซิเซ็ปเตอร์และที่เดนไดรต์ของ projection neuron ดังนั้น จึงชัดเจนว่า วิถีประสาทนำออกจากสมองที่มีหน้าที่ควบคุมความเจ็บปวดมีกลไกต่าง ๆ ในที่ที่สมควรเพื่อควบคุมการส่งสัญญาณของโนซิเซ็ปเตอร์ อันอำนวยโดยสารเข้าฝิ่นซึ่งออกฤทธิ์ที่หน่วยรับสารเข้าฝิ่นของนิวรอนต่าง ๆ ในวิถีประสาท[44]
กระบวนการระงับความปวดอื่น ๆ ส่วนกลาง
[แก้]นอกจากผลระงับความปวดที่พบใน gate control theory และวิถีประสาทที่เริ่มจาก Periaqueductal grey แล้ว ยังอาจมีวิถีประสาทอื่น ๆ ที่ช่วยระงับควบคุมความปวด[42]
การยับยั้งความเจ็บเพราะเจ็บที่อื่น (Diffuse noxious inhibitory control, DNIC) เป็นการหยุดเจ็บในที่หนึ่งเพราะไปเจ็บอีกที่หนึ่งที่อยู่ห่าง ๆ ซึ่งอาจเป็นกลไกการทำงานของการฝังเข็มหรือการนวดหนัก ๆ[42] คือ นิวรอนแบบ wide dynamic range ในปีกหลังของไขสันหลังที่ตอบสนองต่อสิ่งเร้าในที่หนึ่ง อาจลดหรือหยุดการส่งสัญญาณเนื่องจากสิ่งเร้าอันตรายที่อยู่ห่าง ๆ อีกที่หนึ่ง[48] เป็นกระบวนการที่เชื่อว่าเริ่มต้นจากสมอง (medulla[37][49]) และเชื่อว่ามีผลต่อทั้งนิวรอนแบบ wide dynamic range และนิวรอนที่ตอบสนองโดยเฉพาะต่อโนซิเซ็ปเตอร์ในปีกหลังของไขสันหลัง[50] แต่งานศึกษาที่ตรวจสอบความแตกต่างระหว่างเพศของ DNIC พบว่า ผลที่ได้จะไม่แน่นอนขึ้นอยู่กับระเบียบวิธีการศึกษาและวิธีการวัด[51]
การยับยั้งความเจ็บปวดจากสมองสัมพันธ์กับความคาดหวัง (Expectancy-related cortical activation) คือความคาดหวังของบุคคล (เช่นที่พบในปรากฏการณ์ยาหลอก) สามารถมีอิทธิพลต่อระบบควบคุมความเจ็บปวดและให้ผลระงับความเจ็บปวดที่เป็นจริงและวัดได้ โดยมีวิถีประสาทเหมือนกับหรือคาบเกี่ยวกับวิถีประสาทควบคุมความเจ็บปวดจากสมอง[42]
โนซิเซ็ปเตอร์ในสัตว์ไม่ได้เลี้ยงลูกด้วยนม
[แก้]โนซิเซ็ปเตอร์ปรากฏในสัตว์ไม่ได้เลี้ยงลูกด้วยนมต่าง ๆ รวมทั้งปลา[52] และสัตว์ไม่มีกระดูกสันหลังประเภทต่าง ๆ มากมายรวมทั้งปลิง[53] นีมาโทดา[54] ทากทะเล[55] และแมลงวันทอง[56]
ถึงแม้ว่าเซลล์ประสาทเหล่านี้ มีวิถีประสาทและมีความสัมพันธ์กับระบบประสาทกลางที่แตกต่างกัน เทียบกับโนซิเซ็ปเตอร์ของสัตว์เลี้ยงลูกด้วยนม แต่ว่า โนซิเซ็ปเตอร์ของสัตว์ไม่ได้เลี้ยงลูกด้วยนม ก็ยังยิงสัญญาณเพื่อตอบสนองต่อตัวกระตุ้นที่คล้ายกันกับตัวกระตุ้นในสัตว์เลี้ยงลูกด้วยนม ตัวอย่างเช่น ความร้อน (40 องศาเซลเซียสหรือมากกว่านั้น) สภาวะกรด แคปไซซิน และความเสียหายในเนื้อเยื่อ
การใช้ศัพท์
[แก้]เนื่องจากความเข้าใจที่บกพร่องเกี่ยวกับระบบการรับรู้ความเจ็บปวด โนซิเซ็ปเตอร์จึงถูกเรียกอีกอย่างหนึ่งว่า "ตัวรับรู้ความเจ็บปวด (pain receptors)" การใช้คำนี้ไม่เข้ากันกับนิยามปัจจุบันของความเจ็บปวด ซึ่งกำหนดว่าเป็นประสบการณ์ที่เป็นอัตวิสัย[J]
เชิงอรรถ
[แก้]- ↑ ช่องทีอาร์พี (TRP channel หรือ Transient receptor potential channel) เป็นกลุ่มของช่องไอออนโดยมากอยู่บนเยื่อหุ้มเซลล์ของเซลล์มากมายทั้งในมนุษย์และในสัตว์ มีช่องทีอาร์พีมากกว่า 28 ชนิดที่มีโครงสร้างคล้าย ๆ กัน ซึ่งแบ่งออกเป็น 2 กลุ่ม ช่องเหล่านี้สื่อความรู้สึกประเภทต่าง ๆ รวมทั้งความเจ็บปวด อุณหภูมิ รสชาติต่าง ๆ ความกดดัน และการเห็น
- ↑ อะมีน (amine) เป็นตระกูลสารประกอบอินทรีย์และหมู่ฟังก์ชันที่มีอะตอมไนโตรเจนประกอบด้วยอิเล็กตรอนคู่โดดเดี่ยว อะมีนเป็นอนุพันธ์ของแอมโมเนีย โดยที่อะตอมไฮโดรเจนอะตอมหนึ่งหรือเกินกว่านั้นจะทดแทนด้วยอะตอมของกลุ่มอัลเคนและกลุ่มอะรัล
- ↑ แหล่งข้อมูลอื่นระบุชั้นปีกหลังของไขสันหลังต่าง ๆ กัน คือ
- Purves et al 2008b, Figure 10.3, pp. 235 ระบุ
- ใยกลุ่ม C ไปสุดที่ชั้น 1 (marginal layer) และ 2 (Substantia gelatinosa)
- ใยกลุ่ม Aδ ไปสุดที่ชั้น 1 และ 5
- Huether et al 2014, Figure 16-1, pp. 486
- ใยกลุ่ม C ไปสุดที่ชั้น 2 และ 5
- ใยกลุ่ม Aδ ไปสุดที่ชั้น 2
- ผู้เขียนกลุ่มนี้อาจแสดงว่า ใยประสาทใน Lissauer's tract (dorsolateral tract) เป็นของ second order neuron (interneuron) ซึ่งส่งแอกซอนขึ้น/ลง 1-2 ข้อต่อของไขสันหลังแล้วไปสุดที่ชั้น 1 และ 2 ของปีกหลังของไขสันหลังที่ต่างระดับกัน[24]
- Purves et al 2008b, Figure 10.3, pp. 235 ระบุ
- ↑ 4.0 4.1 midline thalamic nuclei หมายถึงนิวเคลียสของทาลามัสที่อยู่ทางด้าน medial ของ ventral posterior nucleus (VPN)[28]
- ↑ 5.0 5.1 ข้อมูลเกี่ยวกับความเจ็บปวดจะส่งขึ้นไปยังสมองตามวิถีประสาทต่าง ๆ รวมทั้ง Spinothalamic tract, Spinocervical tract, Spinoreticular tract, Spinomesencephalic tract, Spinohypothalamic tract, Spinoparabrachial tract, และ Spinolimbic tract[29]
- ↑ 6.0 6.1 อัลโลดีเนีย (allodynia) เป็นความเจ็บปวดที่เกิดขึ้นจากตัวกระตุ้น ที่ตามปกติแล้ว ไม่ก่อให้เกิดความเจ็บปวด ตัวกระตุ้นโดยอุณหภูมิหรือโดยแรงกลสามารถก่อให้เกิดอัลโลดีเนีย และมักจะเกิดขึ้นหลังจากความบาดเจ็บในเขต ๆ หนึ่ง อัลโลดีเนียต่างจากภาวะรู้สึกเจ็บมากกว่าปรกติ (hyperalgesia) ซึ่งเกิดจากปฏิกิริยาที่เพิ่มความเจ็บปวดเกินจริง ต่อตัวกระตุ้นที่ปกติก่อให้เกิดความเจ็บปวด
- ↑ เนื้อเทารอบท่อน้ำสมอง (periaqueductal grey) เป็นเนื้อเทาที่อยู่รอบ ๆ ท่อน้ำสมอง ใน tagmentum ของสมองส่วนกลาง มีบทบาทในการปรับระดับความเจ็บปวดที่ส่งมาที่ระบบประสาทส่วนปลาย และในพฤติกรรมป้องกันตัว
- ↑ 8.0 8.1 Purves et al (2008b) ระบุว่า periaqueductal grey ส่งสัญญาณไปยัง parabrachial nucleus, reticular formation ใน medulla, locus ceruleus, และ Raphe nuclei ซึ่งก็ส่งสัญญาณต่อไปยังปีกหลังของไขสันหลัง[45]
- ↑ Huether et al (2014) ระบุว่า
- enkephalin เป็นสารโอปิออยด์ธรรมชาติที่มีมากสุด และพบในไฮโปทาลามัส, เนื้อเทารอบท่อน้ำสมอง (PAG), nucleus raphes magnus (NPG), และปีกหลังของไขสันหลัง
- endorphin พบใน PAG และ β-endorphin พบในไฮโปทาลามัสและต่อมใต้สมอง
- dynorphin มีฤทธิ์แรงสุด พบในไฮโปทาลามัส, ก้านสมอง, PAG-rostral ventromedial medulla system, และไขสันหลังรวมทั้งปีกหลัง
- ↑ คือ การยิงศักยะงานของโนซิเซ็ปเตอร์ และระดับการยิงศักยะงาน ไม่ได้ก่อให้เกิดความเจ็บปวดโดยตรง แต่ว่า โนซิเซ็ปเตอร์ส่งข้อมูลที่อาจจะก่อให้เกิดความรู้สึกเจ็บปวดในที่สุด ไปยังระบบประสาทกลาง และระบบประสาทกลางนั่นแหละ มีปฏิกิริยาซึ่งในที่สุดให้ผลเป็นความรู้สึกเจ็บปวดซึ่งเป็นอัตวิสัย
อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 Purves et al 2008b, Nociceptors, pp. 231-232; Figure 10.2, pp. 233
- ↑ Johnson et al 2003, Detecting Temperature and Pressure, pp. 1107
- ↑ 3.0 3.1 Huether et al 2014, Nociceptors, pp. 485-486
- ↑ Basbaum & Jessell 2013, pp. 530, 545, 552
- ↑ Purves et al 2008b, Descending Control of Pain Perception, pp. 245, 247
- ↑ Sherrington, C (1906). The Integrative Action of the Nervous System. Oxford: Oxford University Press.
- ↑ Huether et al 2014, Table 16-1 Stimuli that Activate Nociceptors, pp. 486
- ↑ Saladin 2010b, Pain, pp. 592-595 (608-611)
- ↑ Mense 2008, Introduction, pp. 12-14
- ↑ 10.0 10.1 Basbaum & Jessell 2013, Signals from Nociceptors Are Conveyed to Neurons in the Dorsal Horn of the Spinal Cord, pp. 534-536
- ↑ Fein, A. "Nociceptors: the cells that sense pain" (PDF).
- ↑ 12.0 12.1 12.2 Basbaum & Jessell 2013, Noxious Insults Activate Nociceptors, pp. 531-534
- ↑ 13.0 13.1 Gardner & Johnson 2013a, p. 486 อ้างอิง
- Julius, D; Basbaum, AI (2001). "Molecular mechanisms of noiception". Nature. 413: 203–210.
- ↑ Johnson 2008, 6.16.2.1 Receptor Structure and Function, p. 333
- ↑ Gardner & Johnson 2013a, Thermo Receptors Detect Changes in Skin Temperature, 485-486; Figure 22-8, 487
- ↑ 16.0 16.1 16.2 Lackie, JM (2007). The Dictionary of Cell and Molecular Biology (4th ed.). Elsevier. TRP Channels, p. 433. ISBN 978-0-12-373986-5.
Capsaicin and resiniferatoxin are agonists for TRPV1, menthol for TRPM8 (cold receptor), and icilin for both TRPM8 and TRPA1.
- ↑ Simons & Carstens 2008, Table 1 Thermo- and chemosensitive transient receptor potentials (TRPs), p. 350
- ↑ 18.0 18.1 18.2 18.3 Gold & Caterina 2008, 5.04.2.1.3 Transient receptor potential ion channels, pp. 51-53
- ↑ 19.0 19.1 Purves et al 2008b, Transduction of Nociceptive Signals, pp. 233
- ↑ Woolf, CJ; Ma, Q (August 2007). "Nociceptors—noxious stimulus detectors". Neuron. 55 (3): 353–64. doi:10.1016/j.neuron.2007.07.016. PMID 17678850.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Fein, Alan. "Nociceptors: the cells that sense pain".
- ↑ Saladin 2010a, pp. 486 (502)
- ↑ ศ.พญ. ผาสุก มหรรฆานุเคราะห์ (พ.ศ. 2556). ประสาทกายวิภาคศาสตร์พื้นฐาน (ฺBasic neuroanatomy). กรุงเทพมหานคร: ศ.พญ. ผาสุก มหรรฆานุเคราะห์. ISBN 978-616-335-105-0.
{{cite book}}: ตรวจสอบค่าวันที่ใน:|year=(help) - ↑ Huether et al 2014, Pathways of Nociception, pp. 487; Figure 16-3, pp. 488
- ↑ Gardner & Johnson 2013a, p. 488-495
- ↑ Gardner & Johnson 2013a, p. 488
- ↑ 27.0 27.1 Purves et al 2008b, p. 241-242
- ↑ 28.0 28.1 Purves et al 2008b, Parallel Pain Pathways, pp. 237-241; Figure 10.6, pp. 242
- ↑ Willis 2008, 6.06.2.3 Nociceptive Circuits, p. 95-96
- ↑ Purves et al 2008b, p. 238, 241
- ↑ Purves et al 2008b, Central Pain Pathways Are Distinct from Mechanosensory Pathways, pp. 233-237; Parallel Pain Pathways, pp. 237-241; Figure 10.6, pp. 242
- ↑ 32.0 32.1 Purves et al 2008b, Sensitization, pp. 243-245
- ↑ Hucho T, Levine JD (August 2007). "Signaling pathways in sensitization: toward a nociceptor cell biology". Neuron. 55 (3): 365–76. doi:10.1016/j.neuron.2007.07.008. PMID 17678851.
- ↑ 34.0 34.1 34.2 34.3 Basbaum & Jessell 2013, Hyperalgesia Has Both Peripheral and Central Origins, pp. 536-541; Figure 24-10 Mechanisms for enhanced excitability of dorsal horn neurons, pp. 542
- ↑ Huether et al 2014, Box 16-1 Stimuli that Activate Nociceptors, pp. 489
- ↑ Baynes, John W; Dominiczak, Marek H (2005). Medical Biochemistry (2nd ed.). Elsevier. pp. 555. ISBN 0-7234-3341-0.
- ↑ 37.0 37.1 Huether et al 2014, Neurotransmitters of Pain Modulation, pp. 489-491
- ↑ 38.0 38.1 Fields, HL; Rowbotham, M; Baron, R (October 1998). "Postherpetic neuralgia: irritable nociceptors and deafferentation". Neurobiol. Dis. 5 (4): 209–27. doi:10.1006/nbdi.1998.0204. PMID 9848092.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Mense 2008, 5.03.5.2 The Axon Reflex, pp. 37
- ↑ Basbaum & Jessell 2013, Cingulate and Insular Areas are Active During the Perception of Pain, pp. 545; Box 24-1 Localizing Illusory Pain in the Cerebral Cortex, pp. 546
- ↑ 41.0 41.1 Basbaum & Jessell 2013, Pain Perception Is Regulated by a Balance of Activity in Nociceptive and Non-nociceptive Afferent Fibers, pp. 545-546
- ↑ 42.0 42.1 42.2 42.3 Huether et al 2014, Pathways of Modulation, pp. 487-489
- ↑ "Pain Pathway". สืบค้นเมื่อ 2008-06-02.[ลิงก์เสีย]
- ↑ 44.0 44.1 44.2 Basbaum & Jessell 2013, Morphine Controls Pain by Activating Opoid Receptor, pp. 550-552
- ↑ Purves et al 2008b, Figure 10.8 (A), pp. 249
- ↑ 46.0 46.1 Basbaum & Jessell 2013, Electrical Stimulation of the Brain Produces Analgesia, pp. 546-548
- ↑ 47.0 47.1 Basbaum & Jessell 2013, Endogeneous Opioid Peptides and Their Receptors Are Distributed in Pain-Modulatory Systems, pp. 549
- ↑ Le Bars, D; Dickenson, AH; Besson, JM (June 1979). "Diffuse noxious inhibitory controls (DNIC). I. Effects on dorsal horn convergent neurones in the rat". Pain. 6 (3): 283–304. PMID 460935.
- ↑ Huether et al 2014, pp. 519 "The higher brain center also can influence painful stimuli heterosegmental control of nociception as well as inhibition from the caudal medulla (diffuse noxious inhibitory controls)."
- ↑ Le Bars, D (October 2002). "The whole body receptive field of dorsal horn multireceptive neurones". Brain Research Reviews. 40 (1–3): 29–44. PMID 12589904.
- ↑ doi:10.1016/j.pain.2010.05.013
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ doi:10.1098/rspb.2003.2349
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ Pastor, J; Soria, B; Belmonte, C (1996). "Properties of the nociceptive neurons of the leech segmental ganglion". Journal of Neurophysiology. 75: 2268–2279. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-03-05. สืบค้นเมื่อ 2013-09-09.
- ↑ Wittenburg, N; Baumeister, R (1999). "Thermal avoidance in Caenorhabditis elegans: an approach to the study of nociception". Proceedings of the National Academy of Sciences of the United States of America. 96: 10477–10482.
- ↑ Illich, PA; Walters, ET (1997). "The Journal of Neuroscience". Mechanosensory neurons innervating Aplysia siphon encode noxious stimuli and display nociceptive sensitization. 17: 459–469.
- ↑ doi:10.1016/S0092-8674(03)00272-1
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand
แหล่งอ้างอิงอื่น ๆ
[แก้]- Huether, Sue E; Rodway, George; DeFriez, Curtis (2014). "16 - Pain, Temperature Regulation, Sleep, and Sensory Function". ใน McCance, Kathryn L; Huether, Sue E; Brashers, Valentina L; Neal S, Rote. (บ.ก.). Pathophysiology: the biologic basis for disease in adults and children (7th ed.). Mosby. ISBN 978-0-323-08854-1.
- Johnson, George B.; Raven, Peter H.; Singer, Susan; Losos, Jonathan (2002). "Biology/6e" (PDF). McGraw-Hill Higher Education. สืบค้นเมื่อ 2013-02-23.
- Anatomy and Physiology: The Unity of Form and Function (2010)
- Saladin, KS (2010a). "13: The Spinal Cord, Spinal Nerves, and Somatic Reflexes". Anatomy and Physiology: The Unity of Form and Function (5th ed.). New York: McGraw-Hill. ISBN 978-0-39-099995-5.
- Saladin, KS (2010b). "16: Sense Organ". Anatomy and Physiology: The Unity of Form and Function (5th ed.). New York: McGraw-Hill. ISBN 978-0-39-099995-5.
- Neuroscience (2008)
- Purves, Dale; Augustine, George J; Fitzpatrick, David; Hall, William C; Lamantia, Anthony Samuel; McNamara, James O; White, Leonard E, บ.ก. (2008a). "9 - The Somatic Sensory System: Touch and Proprioception". Neuroscience (4th ed.). Sinauer Associates. pp. 207–229. ISBN 978-0-87893-697-7.
- Purves, Dale; Augustine, George J; Fitzpatrick, David; Hall, William C; Lamantia, Anthony Samuel; McNamara, James O; White, Leonard E, บ.ก. (2008b). "10 - Pain". Neuroscience (4th ed.). Sinauer Associates. pp. 231–251. ISBN 978-0-87893-697-7.
- Principles of Neural Science (2013)
- Gardner, Esther P; Johnson, Kenneth O (2013a). "22 - The Somatosensory System: Receptors and Central Pathway". ใน Kandel, Eric R; Schwartz, James H; Jessell, Thomas M; Siegelbaum, Steven A; Hudspeth, AJ (บ.ก.). Principles of Neural Science (5th ed.). United State of America: McGraw-Hill. pp. 475-497. ISBN 978-0-07-139011-8.
- Basbaum, Allan I; Jessell, Thomas M (2013). "24 - Pain". ใน Kandel, Eric R; Schwartz, James H; Jessell, Thomas M; Siegelbaum, Steven A; Hudspeth, AJ (บ.ก.). Principles of Neural Science (5th ed.). United State of America: McGraw-Hill. pp. 530-555. ISBN 978-0-07-139011-8.
- The Senses: A Comprehensive Reference (2008)
- Simons, CT; Carstens, E (2008). Firestein, Stuart; Beauchamp, Gary K (บ.ก.). 4.18 Oral Chemesthesis and Taste. The Senses: A Comprehensive Reference. Vol. 4: Olfaction & Taste. Elsevier.
- Mense, S (2008). Bushnell, Catherine; Basbaum, Allan I (บ.ก.). 5.03 Anatomy of Nociceptors. The Senses: A Comprehensive Reference. Vol. 5: Pain. Elsevier.
- Gold, MS; Caterina, MJ (2008). Bushnell, Catherine; Basbaum, Allan I (บ.ก.). 5.04 Molecular Biology of the Nociceptor/Transduction. The Senses: A Comprehensive Reference. Vol. 5: Pain. Elsevier.
- Willis, WD (Jr) (2008). Kaas, JH; Gardner, EP (บ.ก.). 6.06 Physiological Characteristics of Second-Order Somatosensory Circuits in Spinal Cord and Brainstem. The Senses: A Comprehensive Reference. Vol. 6: Somatosensation. Elsevier.
- Johnson, JI (2008). Kaas, JH; Gardner, EP (บ.ก.). 6.16 Specialized Somatosensory Systems. The Senses: A Comprehensive Reference. Vol. 6: Somatosensation. Elsevier.
