เซลล์ขน
| เซลล์ขน (Hair cell) | |
|---|---|
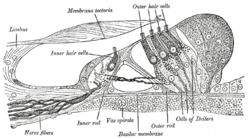 อวัยวะของคอร์ติผ่าขยาย เซลล์ขนด้านนอก (Outer hair cell) อยู่ด้านบน เซลล์ขนด้านใน (inner hair cell) อยู่ตรงกลาง | |
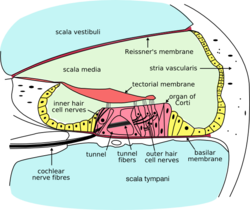 ภาพตัดขวางของหูชั้นในรูปหอยโข่ง (คอเคลีย) เซลล์ขนด้านในอยู่ที่ปลายของ inner hair cell nerves และ เซลล์ขนด้านนอกอยู่ที่ปลายของ outer hair cell nerves | |
| รายละเอียด | |
| ที่ตั้ง | คอเคลีย |
| รูปร่าง | เฉพาะเจาะจง (ดูบทความ) |
| หน้าที่ | ขยายคลื่นเสียงและถ่ายโอนเสียงเป็นสัญญาณประสาทแล้วส่งไปที่ก้านสมอง |
| สารส่งผ่านประสาท | กลูตาเมต |
| การเชื่อมหลังจุดประสานประสาท | ผ่านโสตประสาท (auditory nerve) ไปยัง vestibulocochlear nerve แล้วไปยัง inferior colliculus |
| ตัวระบุ | |
| นิวโรเล็กซ์ ID | sao1582628662, sao429277527 |
| ศัพท์ทางกายวิภาคของประสาทกายวิภาคศาสตร์ | |
เซลล์ขน (อังกฤษ: Hair cell) เป็นเซลล์รับความรู้สึก (sensory receptor) ของทั้งระบบการได้ยินและระบบการทรงตัว (vestibular system) ในหูชั้นในของสัตว์มีกระดูกสันหลัง โดยตรวจจับการเคลื่อนไหวของน้ำในระบบผ่านกระบวนการถ่ายโอนแรงกล (mechanotransduction)[1] ในสัตว์เลี้ยงลูกด้วยนม เซลล์ขนรับเสียงอยู่ในอวัยวะของคอร์ติ ซึ่งอยู่บนเยื่อกั้นหูชั้นใน (basilar membrane) ในอวัยวะรูปหอยโข่ง (คอเคลีย) ชื่อของเซลล์มาจากมัดขนที่เรียกว่า stereocilia ที่ยื่นออกมาจากเยื่อหุ้มเซลล์ด้านบน (apical) เข้าไปในน้ำของท่อคอเคลีย (cochlear duct) เซลล์ขนในคอเคลียของสัตว์เลี้ยงลูกด้วยนมสามารถแบ่งโดยกายวิภาคและหน้าที่เป็นสองอย่าง คือ เซลล์ขนด้านนอก (outer hair cell, OHC) และเซลล์ขนด้านใน (inner hair cell, IHC) ความเสียหายต่อเซลล์ขนทำให้ได้ยินน้อยลง และเพราะว่า เซลล์ขนไม่สามารถเกิดใหม่ ดังนั้น ความเสียหายก็จะคงยืน[2] แต่ว่า ก็ยังมีสิ่งมีชีวิตอื่น ๆ เช่น ปลาม้าลายและสัตว์ปีกที่เซลล์ขนสามารถเกิดใหม่ได้[3][4] คอเคลียของมนุษย์มี IHC ประมาณ 3,500 ตัว และ OHC 12,000 ตัว[5] OHC มีหน้าที่ขยายเสียงเบา ๆ ที่เข้ามาในคอเคลีย (แต่ไม่ขยายเสียงที่ดังถึงระดับหนึ่งแล้ว) ซึ่งอาจเกิดจากการเคลื่อนไหวของมัดขน หรือว่า จากการเคลื่อนไหวของตัวเซลล์เองที่ได้พลังงานจากไฟฟ้า ส่วน IHC จะเปลี่ยนแรงสั่นของเสียงในน้ำไปเป็นสัญญาณไฟฟ้าที่ส่งผ่านโสตประสาท (auditory nerve) ไปยังก้านสมอง และต่อไปยังคอร์เทกซ์การได้ยิน (auditory cortex) เพื่อแปลและประมวลผลต่อ ๆ ไป
เซลล์ขนด้านใน - เปลี่ยนเสียงเป็นสัญญาณประสาท
[แก้]
การขยับ stereocilia ของเซลล์ขนจะเปิดช่องไอออนเปิดปิดด้วยแรงกล ทำให้ไอออนมีประจุบวก (โดยหลักเป็นโพแทสเซียมและแคลเซียม) ไหลเข้ามาในเซลล์[6] ไม่เหมือนกับเซลล์ที่ทำงานด้วยไฟฟ้าอื่น ๆ เซลล์ขนเองจะไม่ยิงศักยะงาน แต่การไหลของไอออนบวกจากน้ำ endolymph ในช่อง scala media เข้ามาจะทำให้เซลล์ลดขั้ว แล้วเกิดศักย์ตัวรับความรู้สึก (receptor potential) ซึ่งก็จะเปิดช่องแคลเซียมที่เปิดปิดโดยศักย์ไฟฟ้า (voltage gated calcium channel) ไอออนแคลเซียมที่ไหลเข้ามาก็จะทำให้เซลล์ปล่อยสารสื่อประสาทที่ด้านฐาน (basal lamina) ของเซลล์ ซึ่งจะแพร่ข้ามช่องแคบ ๆ ระหว่างเซลล์กับปลายประสาท เข้ายึดกับหน่วยรับสารสื่อประสาทแล้วจุดชนวนให้เกิดศักยะงานในเส้นประสาท โดยวิธีการนี้ แรงสั่นที่เป็นสัญญาณเสียงจึงกลายเป็นสัญญาณประสาทที่เป็นไฟฟ้าได้
การกลับขั้วหลังจากการลดขั้วของเซลล์ขนมีลักษณะพิเศษ คือ น้ำ perilymph ใน scala tympani มีไอออนบวกในระดับต่ำมาก ความแตกต่างทางเคมีไฟฟ้าจึงทำให้ไอออนบวกไหลออกจากช่องต่าง ๆ ของเซลล์ไปยัง perilymph
ไอออน Ca2+ ยังรั่วเข้ามาในเซลล์ขนเป็นครั้งเป็นคราวด้วย ซึ่งทำให้ปล่อยสารสื่อประสาทแบบเรื่อย ๆ (tonic) ที่จุดประสานประสาท (ไซแนปส์) เชื่อว่าการปล่อยสารสื่อประสาทเรื่อย ๆ เช่นนี้ทำให้เซลล์ขนสามารถตอบสนองต่อสิ่งเร้าเชิงกลอย่างรวดเร็ว แต่ความเร็วก็อาจมาจากสมรรถภาพในการเพิ่มสารสื่อประสาทที่ปล่อยตอบสนองต่อการเปลี่ยนแปลงเพียงแค่ 100 μV ของศักย์เยื่อหุ้มเซลล์ (membrane potential) ได้เหมือนกัน[7]
เซลล์ขนด้านนอก - ตัวขยายเสียง
[แก้]ในเซลล์ขนด้านนอก (OHC) ของสัตว์เลี้ยงลูกด้วยนม การเกิดศักย์ตัวรับความรู้สึก (receptor potential) จะจุดชนวนให้ตัวเซลล์สั่นอย่างแอคทีฟ การตอบสนองเชิงกลต่อสัญญาณไฟฟ้าเช่นนี้ซึ่งเรียกว่า somatic electromotility (การเคลื่อนไหวของตัวเซลล์เองโดยไฟฟ้า)[8] จะทำให้ตัวเซลล์ยืดและหด โดยจะเกิดกับเซลล์ที่ไวความถี่เสียงที่เข้ามาในหู (ซึ่งเป็นตำแหน่งเฉพาะที่เยื่อกั้นหูชั้นใน) เป็นการเพิ่มขยายเสียงแบบป้อนกลับเชิงบวก[9] แต่ OHC พบแต่ในสัตว์เลี้ยงลูกด้วยนมเท่านั้น แม้ว่า สัตว์เลี้ยงลูกด้วยนมจะไวเสียงเท่า ๆ กับสัตว์มีกระดูกสันหลังอื่น ๆ แต่ถ้า OHC ไม่ทำงาน ระดับความไวเสียงจะลดลงประมาณ 50 dB
OHC สามารถยืดความถี่เสียงที่ได้ยินไปถึง 200 kHz ในสัตว์เลี้ยงลูกด้วยนมในน้ำบางชนิด[10] และสามารถช่วยการได้ยินเสียงที่ความถี่โดยเฉพาะ ๆ (frequency discrimination) ซึ่งให้ประโยชน์ต่อมนุษย์ เพราะทำให้สามารถแยกแยะเสียงพูดและเสียงดนตรีที่ซับซ้อน ระบบเช่นนี้ขยายเสียงเบา ๆ มากกว่าเสียงที่ดัง (คือไม่ได้ขยายในรูปแบบฟังก์ชันเชิงเส้น) ทำให้แรงดันเสียงมีพิสัยกว้างสามารถเปลี่ยนเป็นการขยับขนเซลล์ในระยะที่มีพิสัยน้อยกว่า[11]
คุณสมบัติการขยายเสียงเช่นนี้เรียกว่า cochlear amplifier อณูชีววิทยาเกี่ยวกับเซลล์ขนได้เกิดความก้าวหน้าเร็ว ๆ นี้ เมื่อนักวิทยาศาสตร์ได้กำหนดโปรตีนมอร์เตอร์ (motor protein) คือ prestin ที่เป็นมูลฐานการเคลื่อนไหวของตัวเซลล์เองโดยไฟฟ้า (somatic electromotility) ของ OHC คือเมื่อเร้าเซลล์ OHC ในการทดลอง นักวิทยาศาสตร์พบว่าเมื่อเซลล์ลดขั้ว (depolarized) เซลล์ก็จะสั้นลง และเมื่อเซลล์เพิ่มขั้ว เซลล์ก็จะยาวขึ้น ซึ่งเป็นผลของการเปลี่ยนทิศทางของโมเลกุล prestin เป็นล้าน ๆ โมเลกุลในเซลล์[12]
การทำงานของ prestin พบว่า ขึ้นอยู่กับการส่งสัญญาณผ่านช่องคลอไรด์ (chloride channel) ซึ่งสามารถเกิดเสียหายได้จากสารฆ่าศัตรูพืชและสัตว์ tributyltin เพราะว่า สารพิษนี้สามารถส่งต่อขึ้นไปตามลำดับโซ่อาหาร จึงเกิดผลเสียหายที่ชัดเจนในสัตว์ล่าเหยื่อเหนือโซ่สุด เช่นวาฬเพชฌฆาตและวาฬมีฟัน[13]
การเชื่อมต่อทางประสาท
[แก้]นิวรอนของ auditory nerve (โสตประสาท) หรือ vestibulocochlear nerve ซึ่งเป็นเส้นประสาทสมองที่ 8 เป็นตัวส่งสัญญาณต่อจากเซลล์ขนของคอเคลีย และระบบทรงตัว (vestibular system)[14] สารสื่อประสาทที่เซลล์ขนปล่อยเพื่อเร้าปลายประสาทของนิวรอนนำเข้า (afferent) ไปยังสมองเชื่อว่าเป็นกลูตาเมต มีโครงสร้างก่อนไซแนปส์ของเซลล์ขนที่เรียกว่า presynaptic dense body หรือ ribbon synapse ซึ่งล้อมไปด้วยถุงไซแนปส์ (synaptic vesicle) และเชื่อว่าช่วยให้สามารถปล่อยสารสื่อประสาทได้อย่างรวดเร็ว
มีเส้นประสาทไปยัง IHC มากกว่า OHC มาก IHC เซลล์เดียวมีเส้นประสาทเชื่อมต่อเป็นจำนวนมาก แต่ว่าเส้นประสาทเส้นเดียวจะเชื่อมกับ OHC เป็นจำนวนมาก เส้นประสาทไปยัง IHC ยังหุ้มด้วยปลอกไมอีลินด้วย ในขณะที่เส้นประสาทไปยัง OHC ไม่มี บริเวณ/ตำแหน่งของเยื่อกั้นหูชั้นใน (basilar membrane) ที่ส่งข้อมูลไปทางใยประสาทนำเข้าสามารถพิจารณาว่าเป็นลานรับสัญญาณ (receptive field) ของใยประสาท
ใยประสาทนำออกจากสมองไปยังคอเคลียก็มีบทบาทต่อการได้ยินเสียงด้วย ใยประสาทจะวิ่งไปสุดที่ OHC และที่ใยประสาทนำเข้าของ IHC และมีปลายแอกซอน (presynaptic terminal) เต็มไปด้วยถุง (vesicle) ที่มี acetylcholine และ neuropeptide ที่เรียกว่า calcitonin gene-related peptide สารประกอบเหล่านี้จะมีฤทธิ์ต่าง ๆ กัน เช่น ในเซลล์ขนบางอย่าง acetylcholine จะทำให้เซลล์เพิ่มขั้ว (hyperpolarized) ซึ่งลดความไวเสียงของคอเคลียตรงนั้น ๆ
การเกิดใหม่
[แก้]งานวิจัยในการสร้างเซลล์คอเคลียขึ้นใหม่อาจจะรักษาปัญหาการได้ยินได้ โดยไม่เหมือนสัตวปีกและปลา มนุษย์และสัตว์เลี้ยงลูกด้วยนมอื่น ๆ ไม่สามารถสร้างเซลล์หูชั้นในที่เปลี่ยนสัญญาณเสียงเป็นสัญญาณประสาทขึ้นมาใหม่เมื่อเกิความเสียหายเพราะอายุหรือเพราะโรค[4][15] นักวิจัยได้สร้างความก้าวหน้าทั้งในการรักษาด้วยยีน (gene therapy) และการรักษาด้วยเซลล์ต้นกำเนิด ที่ในที่สุดอาจช่วยสร้างเซลล์ที่เสียหายขึ้นมาใหม่ เพราะว่าเซลล์ขนของทั้งระบบการได้ยินและระบบการทรงตัว (vestibular system) ของนกและปลาสามารถเกิดใหม่ได้ จึงมีการศึกษาในสัตว์เหล่านี้[4][16] นอกจากนั้นแล้ว เซลล์ขนในอวัยวะของปลาที่เรียกว่า lateral line ซึ่งสามารถถ่ายโอนแรงกลเป็นสัญญาณประสาท ก็พบว่าเกิดใหม่ได้เช่นกันในสัตว์บางชนิดเช่น ปลาม้าลาย[17]
นักวิจัยได้ค้นพบยีนของสัตว์เลี้ยงลูกด้วยนมที่ปกติมีหน้าที่เป็นสวิตช์โมเลกุล (molecular switch) ที่ยุติการสร้างเซลล์ขนขึ้นใหม่ในผู้ใหญ่[18] เป็นยีน Rb1 ซึ่งเข้ารหัส retinoblastoma protein ซึ่งทำหน้าที่เป็นโปรตีนระงับเนื้องอก (tumor suppressor) คือ ยีน Rb จะหยุดเซลล์ไม่ให้แบ่งตัว[19][20] เซลล์ขนในจานเพาะไม่เพียงแต่เกิดใหม่เมื่อลบยีน Rb1 ออกเท่านั้น แต่หนูหริ่งที่ไม่มียีนนี้จะมีเซลล์ขนมากกว่าหนูกลุ่มควบคุมที่มียีนนี้
นอกจากนั้นแล้ว โปรตีน sonic hedgehog ปรากฏว่ายังระงับฤทธิ์ของ retinoblastoma protein และดังนั้นจะทำให้เซลล์ที่หยุดแบ่งตัวแล้วกลับเข้าสู่วัฏจักรเซลล์ ทำให้เซลล์ใหม่เกิดและเจริญขึ้นได้[21]
สารห้ามวัฏจักรเซลล์อีกอย่าง คือ p27kip1 (CDKN1B) ยังพบว่าช่วยให้เซลล์ขนในคอเคลียเกิดใหม่ในหนูหริ่งเมื่อลบหรือระงับการทำงานของ p27 ด้วย siRNA[22][23] งานวิจัยในการสร้างเซลล์ใหม่เช่นนี้ อาจช่วยค้นพบการรักษาการเสียการได้ยินในมนุษย์เพราะเซลล์ขนเสียหายหรือตาย
รูปภาพอื่น ๆ
[แก้]-
lamina reticularis และโครงสร้างรอบ ๆ
-
รูปหูชั้นในแสดงหลอดกึ่งวงกลม (semicircular canal), เซลล์ขน, vestibular nerve, และน้ำ
เชิงอรรถและอ้างอิง
[แก้]- ↑ Lumpkin, Ellen A.; Marshall, Kara L.; Nelson, Aislyn M. (2010). "The cell biology of touch". The Journal of Cell Biology. 191 (2): 237–248. doi:10.1083/jcb.201006074.
- ↑ Nadol, Joseph B. (1993). "Hearing loss". New England Journal of Medicine. 329 (15): 1092–1102. doi:10.1056/nejm199310073291507.
- ↑ Lush, Mark E.; Piotrowski, Tatjana (2013). "Sensory hair cell regeneration in the zebrafish lateral line". Developmental Dynamics. 243 (10): 1187–1202. doi:10.1002/dvdy.24167. PMID 25045019.
- ↑ 4.0 4.1 4.2 Cotanche, Douglas A. (1994). "Hair cell regeneration in the bird cochlea following noise damage or ototoxic drug damage". Anatomy and Embryology. 189 (1): 1–18. doi:10.1007/bf00193125.
- ↑ Pujol, Rémy; Nouvian, Régis; Lenoir, Marc. "Hair cells". cochlea.eu.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Müller, U (October 2008). "Cadherins and mechanotransduction by hair cells". Current Opinion in Cell Biology. 20 (5): 557–566. doi:10.1016/j.ceb.2008.06.004. PMC 2692626. PMID 18619539.
- ↑ Chan DK, Hudspeth AJ (February 2005). "Ca2+ current-driven nonlinear amplification by the mammalian cochlea in vitro". Nature Neuroscience. 8 (2): 149–155. doi:10.1038/nn1385. PMC 2151387. PMID 15643426.
- ↑ Brownell WE, Bader CR, Bertrand D, de Ribaupierre Y (1985-01-11). "Evoked mechanical responses of isolated cochlear outer hair cells". Science. 227 (4683): 194–196. Bibcode:1985Sci...227..194B. doi:10.1126/science.3966153. PMID 3966153.
- ↑ Dancing Hair Cell (A movie clip showing an isolated outer hair cell moving in response to electrical stimulation can be seen ) [เซลล์ขนเต้นระบำ (คลิปภาพยนตร์แสดงเซลล์ขนด้านนอกเดี่ยว ๆ ไหวตอบสนองต่อการเร้าด้วยไฟฟ้า)] (ภาพยนตร์). คณะกายวิภาคศาสตร์, มหาวิทยาลัยออกซฟอร์ด. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ March 7, 2012. สืบค้นเมื่อ 2021-08-10.
- ↑ Wartzog D, Ketten DR (1999). "Marine Mammal Sensory Systems" (PDF). ใน Reynolds J, Rommel S (บ.ก.). Biology of Marine Mammals. Smithsonian Institution Press. p. 132. S2CID 48867300. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ September 19, 2018.
- ↑ Hudspeth AJ (August 28, 2008). "Making an effort to listen: mechanical amplification in the ear". Neuron. 59 (4): 530–45. doi:10.1016/j.neuron.2008.07.012. PMC 2724262. PMID 18760690.
- ↑ Principles of Neural Science, 5th edition (2013), "Chapter 31: The Inner Ear", pp. 672-673
- ↑ Santos-Sacchi Joseph; Song Lei; Zheng Jiefu; Nuttall Alfred L (2006-04-12). "Control of mammalian cochlear amplification by chloride anions". Journal of Neuroscience. 26 (15): 3992–8. doi:10.1523/JNEUROSCI.4548-05.2006. PMC 6673883. PMID 16611815.
- ↑ "Cranial Nerve VIII. Vestibulocochlear Nerve". Meddean. Loyola University Chicago. สืบค้นเมื่อ 2008-06-04.
- ↑ Edge, AS; Chen, ZY (2008). "Hair cell regeneration". Current Opinion in Neurobiology. 18 (4): 377–82. doi:10.1016/j.conb.2008.10.001. PMID 18929656.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Lombarte, Antoni (1993). "Damage and regeneration of hair cell ciliary bundles in a fish ear following treatment with gentamicin". Hearing Research. 64 (2): 166–174. doi:10.1016/0378-5955(93)90002-i.
- ↑ Whitfield, T.T (2002). "Zebrafish as a model for hearing and deafness". Journal of Neurobiology. 53 (2): 157–171. doi:10.1002/neu.10123.
- ↑ Henderson, M (2005-01-15). "Gene that may no longer turn a deaf ear to old age". Times Online.
- ↑ Sage, Cyrille; Huang, Mingqian; Vollrath, Melissa A.; Brown, M. Christian; Hinds, Philip W.; Corey, David P.; Vetter, Douglas E.; Zheng-Yi, Chen (2005). "Essential role of retinoblastoma protein in mammalian hair cell development and hearing". Proceedings of the National Academy of Sciences of the United States of America. 103 (19): 7345–7350. doi:10.1073/pnas.0510631103. PMC 1450112. PMID 16648263.
- ↑
Raphael, Y; Martin, DM (2005). "Deafness: Lack of regulation encourages hair cell growth". Gene Therapy. 12 (13): 1021–22. doi:10.1038/sj.gt.3302523.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Lu, Na; Chen, Yan; Wang, Zhengmin; Chen, Guoling; Lin, Qin; Chen, Zheng-Yi; Li, Huawei (2013). "Sonic hedgehog initiates cochlear hair cell regeneration through downregulation of retinoblastoma protein". Biochemical and Biophysical Research Communications. Elsevier. 430 (2): 700–705. doi:10.1016/j.bbrc.2012.11.088. PMC 3579567. PMID 23211596.
- ↑
Löwenheim, H; Furness, DN; Kil, J; Zinn, C; Gültig, K; Fero, ML; Frost, D; Gummer, AW; Roberts, JM; Rubel, EW; Hackney, CM; Zenner, HP (March 30, 1999). "Gene disruption of p27(Kip1) allows cell proliferation in the postnatal and adult organ of corti". Proc Natl Acad Sci U S A. 96 (7): 4084–8. doi:10.1073/pnas.96.7.4084. PMC 22424. PMID 10097167.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) (primary source) - ↑
Ono, K; Nakagawa, T; Kojima, K; Matsumoto, M; Kawauchi, T; Hoshino, M; Ito, J (December 2009). "Silencing p27 reverses post-mitotic state of supporting cells in neonatal mouse cochleae". Mol Cell Neurosci. 42 (4): 391–8. doi:10.1016/j.mcn.2009.08.011. PMID 19733668.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) (primary source)
อ้างอิงอื่น
[แก้]- Coffin A, Kelley M, Manley GA, Popper AN (2004). "Evolution of sensory hair cells". ใน Manley, และคณะ (บ.ก.). Evolution of the Vertebrate Auditory System. pp. 55–94.
- Fettiplace R, Hackney CM (2006). "The sensory and motor roles of auditory hair cells". Nature Reviews. Neuroscience. 7 (1): 19–29. doi:10.1038/nrn1828. PMID 16371947. S2CID 10155096.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. pp. 590–594. ISBN 0-8385-7701-6.
- Manley GA, Popper AN, Fay RR (2004). Evolution of the Vertebrate Auditory System. New York: Springer-Verlag. ISBN 0-387-21093-8.
- Manley GA (2004). "Advances and perspectives in the study of the evolution of the vertebrate auditory system". ใน Manley, และคณะ (บ.ก.). Evolution of the Vertebrate Auditory System. pp. 360–368.
- Rabbitt RD, Boyle R, Highstein SM (1–5 February 2010). "Mechanical amplification by hair cells in the semicircular canals". Proceedings of the National Academy of Sciences. 107 (8): 3864–9. Bibcode:2010PNAS..107.3864R. doi:10.1073/pnas.0906765107. PMC 2840494. PMID 20133682.
- "Built-in amps: How subtle head motions, quiet sounds are reported to the brain". Medical Xpress. February 9, 2010.
- Breneman KD, Brownell WE, Rabbitt RD (22 April 2009). Brezina V (บ.ก.). "Hair cell bundles: flexoelectric motors of the inner ear". PLOS ONE. 4 (4): e5201. Bibcode:2009PLoSO...4.5201B. doi:10.1371/journal.pone.0005201. PMC 2668172. PMID 19384413.
- "Power steering for your hearing: Ears have tiny 'flexoelectric' motors to amplify sound". Phys.org (Press release). April 22, 2009.
แหล่งข้อมูลอื่น
[แก้]- Molecular Basis of Hearing
- Outer hair cell dancing "rock around the clock"
- Dancing OHC video Yale Ear Lab
- NIF Search - Hair Cell เก็บถาวร 3 มีนาคม 2016 ที่ เวย์แบ็กแมชชีน via the Neuroscience Information Framework
- Hair-Tuning-Sound-Sensor A concise report on the recent development of sound sensors based on hair tuning by students of SMMEE, IIT Ropar



