เมไธโอนีน
 Canonical form of methionine
| |
| ชื่อ | |
|---|---|
| IUPAC name
Methionine
| |
| ชื่ออื่น
2-amino-4-(methylthio)butanoic acid
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ตัวย่อ | Met, M |
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.000.393 |
| EC Number |
|
| KEGG | |
ผับเคม CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ[2] | |
| C5H11NO2S | |
| มวลโมเลกุล | 149.21 g·mol−1 |
| ลักษณะทางกายภาพ | ผงผลึกสีขาว |
| ความหนาแน่น | 1.340 g/cm3 |
| จุดหลอมเหลว | 281 องศาเซลเซียส (538 องศาฟาเรนไฮต์; 554 เคลวิน) decomposes |
| ละลายได้ | |
| pKa | 2.28 (carboxyl), 9.21 (amino)[1] |
| เภสัชวิทยา | |
| V03AB26 (WHO) QA05BA90 (WHO), QG04BA90 (WHO) | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
เมไธโอนีน (อังกฤษ: methionine, ตัวย่อ Met หรือ M)[3] เป็นกรดอะมิโนชนิดแอลฟา มีสูตรเคมีคือ C5H11NO2S ลักษณะเป็นของแข็งสีขาว ละลายน้ำได้ มีมวลโมเลกุล 149.21 g/mol[4] โครงสร้างเมไธโอนีนประกอบด้วยแอมโมเนียที่ได้โปรตอน (−NH3+) และกรดคาร์บอกซิลิกที่เสียโปรตอน (−COO−) และมีโซ่ข้างเป็นไทโออีเทอร์ เมไธโอนีนและซิสตีอีนเป็นกรดอะมิโนโปรตีโนเจนิกสองชนิดที่มีอะตอมกำมะถัน เมไธโอนีนถูกเข้ารหัสในรหัสทางพันธุกรรมพื้นฐานเป็นโคดอน AUG
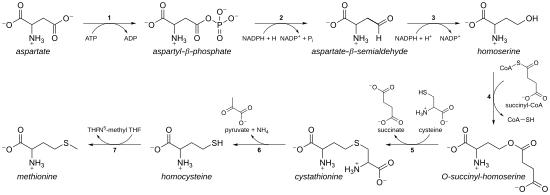
เมไธโอนีนถูกสกัดครั้งแรกในปี ค.ศ. 1921 โดยจอห์น ฮาวเวิร์ด มูลเลอร์ นักเคมีชาวอเมริกัน[5] และได้ชื่อจากการผสมคำระหว่าง methyl, thion และ -ine[6] ชีวสังเคราะห์ของเมไธโอนีนในพืชและจุลชีพเริ่มต้นที่แอสปาร์เตตที่กลายสภาพเป็นแอสปาร์เตต-เบตา-เซมิแอลดีไฮด์แล้วเปลี่ยนเป็นฮอโมเซรีน ต่อมาฮอโมเซรีนจะถูกกระตุ้นร่วมกับหมู่ฟอสเฟต แอซิติลหรือซักซินิล ก่อนจะทำปฏิกิริยากับซิสตีอีน ไฮโดรเจนซัลไฟด์หรือเมทาเนธิออล หากทำปฏิกิริยากับซิสตีอีนหรือไฮโดรเจนซัลไฟด์จะได้กรดอะมิโนฮอโมซิสตีนซึ่งสามารถเปลี่ยนสภาพเป็นเมไธโอนีน แต่หากทำปฏิกิริยากับเมทาเนธิออล จะได้เมไธโอนีนโดยตรง[7][8]
เมไธโอนีนเป็นกรดอะมิโนจำเป็นที่ร่างกายไม่สามารถสังเคราะห์ได้ แต่ได้รับจากอาหารจำพวกเนื้อสัตว์ ปลา และไข่[9] เมไธโอนีนเป็นตัวถูกเปลี่ยนของกรดอะมิโนอื่นอย่างซิสตีอีนและทอรีน เมไธโอนีนเป็นส่วนประกอบสำคัญของกลูตาไธโอน สารต้านอนุมูลอิสระที่สำคัญในสิ่งมีชีวิต และเอส-อะดีโนซิลเมไธโอนีน (SAM-e) โคแฟกเตอร์ที่มีส่วนสำคัญในการควบคุมฮอร์โมน ดีเอ็นเอและระบบภูมิคุ้มกันของร่างกาย[10][11]
อ้างอิง
[แก้]- ↑ Dawson RM, Elliott DC, Elliott WH, Jones KM (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ↑ Weast, Robert C., บ.ก. (1981). CRC Handbook of Chemistry and Physics (62nd ed.). Boca Raton, FL: CRC Press. p. C-374. ISBN 0-8493-0462-8..
- ↑ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. เก็บจากแหล่งเดิมเมื่อ 9 October 2008. สืบค้นเมื่อ 5 March 2018.
- ↑ "L-Methionine - MSDS". Fisher Scientific. สืบค้นเมื่อ October 21, 2019.
- ↑ Pappenheimer AM (1987). "A Biographical Memoir of John Howard Mueller" (PDF). Washington D.C.: National Academy of Sciences.
- ↑ "Definition of methionine". Merriam-Webster. สืบค้นเมื่อ October 21, 2019.
- ↑ Ferla MP, Patrick WM (August 2014). "Bacterial methionine biosynthesis". Microbiology. 160 (Pt 8): 1571–84. doi:10.1099/mic.0.077826-0. PMID 24939187.
- ↑ "L-methionine biosynthesis". BioCyc. สืบค้นเมื่อ October 21, 2019.
- ↑ "Methionine". Healthline. April 13, 2018. สืบค้นเมื่อ October 21, 2019.
- ↑ Ding, Wei; Smulan, Lorissa J.; Hou, Nicole S.; Taubert, Stefan; Watts, Jennifer L.; Walker, Amy K. (2015-10-06). "S-Adenosylmethionine Levels Govern Innate Immunity through Distinct Methylation-Dependent Pathways". Cell Metabolism. 22 (4): 633–645. doi:10.1016/j.cmet.2015.07.013. PMC 4598287. PMID 26321661.
- ↑ "S-adenosyl-L-methionine". Mayo Clinic. October 24, 2017. สืบค้นเมื่อ October 21, 2019.
