โครงข่ายโลหะ−สารอินทรีย์

โครงข่ายโลหะ−สารอินทรีย์ (อังกฤษ: Metal−organic Frameworks: MOFs) หมายถึง โครงข่ายในระดับโมเลกุลที่เกิดจากการสร้างพันธะระหว่างไอออนของโลหะและสารอินทรีย์จนเกิดเป็นโครงสร้างขนาดใหญ่ที่เป็นโครงข่าย (framework)ต่อเนื่องไม่สิ้นสุดหรือโครงข่ายอนันต์ (infinite framework)โดยทั่วไปสารอินทรีย์มักจะเป็นสารที่เป็นโมเลกุลแข็งเกร็ง (rigid molecule) เช่น กรด 1,4−เบนซีนไดคาร์บอกซิลิก กรด 1,3,5−เบนซีนไตรคาร์บอกซิลิก 4,4’−ไบพิริดีน เป็นต้น วัสดุโครงข่ายโลหะ−สารอินทรีย์มีศักยภาพในการนำไปประยุกต์ใช้ในหลากหลายแนว อาทิ การเป็นตัวเร่งปฏิกิริยา [1][2] การกักเก็บแก๊ส [3] การคัดเลือกโมเลกุล เป็นต้น ซึ่งปัจจุบันนักเคมีวัสดุสามารถประยุกต์ใช้วัสดุโครงข่ายโลหะ−สารอินทรีย์ในระดับอุตสาหกรรมได้แล้ว [4]
โครงสร้าง
[แก้]โครงสร้างของโครงข่ายโลหะ−สารอินทรีย์จัดเป็นโคออร์ดิเนชันพอลิเมอร์ (coordination polymers) ที่เกิดจากโลหะอะตอมกลางสร้างพันธะโคออร์ดิเนตโคเวเลนต์กับลิแกนด์ที่มีอะตอมผู้ให้หลายอะตอม ต่อเนื่องกันไป โดยโครงสร้างที่ขยายต่อเนื่องออกไปอาจจะเป็นโครงสร้างที่มี หนึ่งมิติ สองมิติ หรือ สามมิติ
แนวคิดบัพ−ตัวเชื่อม
[แก้]การอธิบายโครงสร้างของโครงข่ายโลหะ−สารอินทรีย์อาจพิจารณาได้จากแนวคิดเรื่อง บัพ (node) และ ตัวเชื่อม (linker) ซึ่งมองว่าไอออนของโลหะเป็นบัพที่เชื่อมต่อเข้าด้วยกันโดยโมเลกุลของสารอินทรีย์ที่ทำหน้าที่เป็นตัวเชื่อม ปัจจุบัน ได้เกิดเคมีสาขาใหม่คือ เคมีเรกติคิวลาร์ (reticular chemistry) ที่ศึกษาเกี่ยวกับโครงข่ายโลหะ−สารอินทรีย์โดยพิจารณาการเชื่อมต่อหน่วยสร้าง (structural building units: SBUs) เข้าด้วยกันโดยพันธะที่แข็งแรงอย่างพันธะโคเวเลนต์ เป็นต้น

รูป:2 การเกิดพันธะโคออร์ดิเนตโคเวเลนต์ระหว่างไอออนของโลหะ M และสารอินทรีย์ที่ทำหน้าที่เป็นตัวเชื่อม สามารถทำให้เกิดโครงสร้าง หนึ่งมิติ สองมิติ หรือ สามมิติได้
เคมีโคออร์ดิเนชันของโลหะ
[แก้]สมบัติทางเคมีโคออร์ดิเนชันของโลหะอะตอมกลางมีอิทธิพลต่อการกำหนดโครงสร้างของโครงข่ายโลหะ−สารอินทรีย์เป็นอย่างมาก เช่น Ag+ มีแนวโน้มที่จะเกิดสารประกอบโคออร์ดิเนชันที่มีเลขโคออร์ดิเนชันเท่ากับ 2 หรือมีรูปทรงเรขาคณิตเป็นเส้นตรง ทำให้โคออร์ดิเนชันพอลิเมอร์ที่เกิดจาก Ag+ มีโอกาสเป็นโครงสร้าง 1 มิติสูง ในขณะที่สังกะสี (Zn2+) สามารถเกิดสารประกอบโคออร์ดิเนชันที่มีเลขโคออร์ดิเนชันเท่ากับ 6 หรือมีรูปทรงเรขาคณิตเป็นทรงแปดหน้าได้ดี จึงมีแนวโน้มที่จะเกิดโคออร์ดิเนชันพอลิเมอร์ 2 มิติหรือ 3 มิติได้มากกว่า
โครงสร้างของตัวเชื่อม
[แก้]สารอินทรีย์ที่ทำหน้าที่เป็นตัวเชื่อมโลหะอะตอมกลางอาจจะเป็นสารกลุ่มกรดคาร์บอกซิลิก (carboxylic acids) เอมีน (amines) เป็นต้น ตัวเชื่อมต้องมีอะตอมผู้ให้มากกว่า 1 อะตอม วางตัวในทิศทางที่จะส่งเสริมให้เกิดโครงสร้างที่ขยายออกไป เช่น กรด 1,4−เบนซีนไดคาร์บอกซิลิก กรดมาโลนิก กรดซักซินิก จัดเป็น ไดโทปิกลิแกนด์ (ditopic ligands) ซึ่งอะตอมผู้ให้หรือหมู่คาร์บอกซิเลตทั้งสองวางตัวอยู่ในทิศทางตรงกันข้ามกัน 180° ในขณะที่ กรด 1,3,5−เบนซีนไตรคาร์บอกซิลิก ซึ่งเป็น ไตรโทปิกลิแกนด์ (tritopic ligands)ที่หมู่คาร์บอกซิเลตวางตัวอยู่ในตำแหน่งที่ทำมุม 120° ทำให้การวางตัวของโลหะอะตอมกลางมีรูปแบบที่แตกต่างกันไป
กรด 1,4−เบนซีนไดคาร์บอกซิลิก กรด 1,3,5−เบนซีนไตรคาร์บอกซิลิก กรด 1,3,เบนซีนไดคาร์บอกซิลิก
นอกจากนี้ การใช้ตัวเชื่อมที่มีโมเลกุลแข็งเกร็งจะสามารถทำนายโครงสร้างที่จะได้ง่ายกว่าการใช้ตัวเชื่อมที่มีความยืดหยุ่นมากกว่า
ตัวเชื่อมโดยทั่วไปในโครงข่ายโลหะ−สารอินทรีย์
[แก้]สารอินทรีย์ที่ใช้เป็นตัวเชื่อมในโครงข่ายโลหะ−สารอินทรีย์มีหลายชนิด ดังตัวอย่างต่อไปนี้
| ชื่อสามัญ | ชื่อ IUPAC | สูตรโมเลกุล | สูตรโครงสร้าง |
|---|---|---|---|
| กรดไดคาร์บอกซิลิก | |||
| กรดออกซาลิก | ethanedioic acid | HOOC-COOH | 
|
| กรดมาโลนิก | propanedioic acid | HOOC-(CH2)-COOH | 
|
| กรดซักซินิก | butanedioic acid | HOOC-(CH2)2-COOH | 
|
| กรดกลูตาริก | pentanedioic acid | HOOC-(CH2)3-COOH | |
| กรดพาทาลิก | benzene-1,2-dicarboxylic acid o-phthalic acid |
C6H4(COOH)2 | 
|
| กรดไอโซพาทาลิก | benzene-1,3-dicarboxylic acid m-phthalic acid |
C6H4(COOH)2 | 
|
| กรดเทอเรพทาริก | benzene-1,4-dicarboxylic acid p-phthalic acid |
C6H4(COOH)2 | 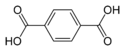
|
| กรดไตรคาร์บอกซิลิก | |||
| กรดซิตริก | 2-Hydroxy-1,2,3-propanetricarboxylic acid | (HOOC)CH2C(OH)(COOH)CH2(COOH) | 
|
| กรดไตรเมสิก | benzene-1,3,5-tricarboxylic acid | C9H6O6 | 
|
| เอโซล | |||
| 1,2,3-ไตรเอโซล | 1H-1,2,3-triazole | C2H3N3 | 
|
| พีโรไดเอโซล | 1H-1,2,4-triazole | C2H3N3 | 
|
การจัดจำแนก
[แก้]นักเคมีวัสดุได้จัดจำแนกสารประกอบโคออร์ดิเนชันออกเป็นชนิดต่างๆโดยพิจารณามิติของการเชื่อมต่อสารอินทรีย์และมิติของการเชื่อมต่อสารอนินทรีย์ ดังนี้
| มิติการเชื่อมต่อของสารอนินทรีย์ | |||||
|---|---|---|---|---|---|
| มิติการเชื่อมต่อของสารอินทรีย์ | 0 | 1 | 2 | 3 | |
| 0 | สารเชิงซ้อนเชิงโมเลกุล(Molecular Complexes) | สายโซ่ไฮบริดอนินทรีย์(Hybrid Inorganic Chains) | ชั้นไฮบริดอนินทรีย์ (Hybrid Inorganic Layers) | สารไฮบริดอนินทรีย์สามมิติ (3-D Inorganic Hybrids) | |
| 1 | สายโซ่โคออร์ดิเนชันพอลิเมอร์ (Chain Coordination Polymers) | ชั้นผสมอนินทรีย์−อินทรีย์ (Mixed Inorganic-Organic Layers) | โครงข่ายสามมิติผสมอนินทรีย์−อินทรีย์ (Mixed Inorganic-Organic 3-D Framework) | ||
| 2 | ชั้นโคออร์ดิเนชันพอลิเมอร์ (Layered Coordination Polymer) | โครงข่ายผสมอนินทรีย์−อินทรีย์สามมิติ (Mixed Inorganic-Organic 3-D Framework) | |||
| 3 | โคออร์ดิเนชันพอลิเมอร์สามมิติ (3-D Coordination Polymers) | ||||
อย่างไรก็ตาม ที่ผ่านมานักเคมีวัสดุไม่มีแนวทางในการเรียกสารประกอบโครงข่ายโลหะ−สารอินทรีย์ที่ชัดเจน จนกระทั่ง สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ หรือ IUPAC ได้มีโครงการสำหรับการจัดจำแนกและเรียกชื่อสารประกอบกลุ่มนี้ให้เป็นไปในทางเดียวกัน [6] และได้ตีพิมพ์ลงในวารสารวิชาการในปี ค.ศ.2012 [7]
การประยุกต์ใช้
[แก้]ในปัจจุบันมีการศึกษาสมบัติของโครงข่ายโลหะ−สารอินทรีย์อย่างแพร่หลาย โดยเฉพาะในประเทศสหรัฐอเมริกา โดยใช้เป็นตัวกักเก็บแก๊สไฮโดรเจน [8] ตัวกักเก็บแก๊สมีเทน [9] ตัวคัดเลือกโมเลกุล [10] ตัวเร่งปฏิกิริยาที่จำเพาะเจาะจงต่อสเตอริโอเคมี [11]
ดูเพิ่ม
[แก้]อ้างอิง
[แก้]- ↑ U. Ravon, M. E. Domine, C. Gaudillere, A. Desmartin-Chomel and D. Farrusseng, (2008). "MOFs as acid catalysts with shape selectivity properties". New J. Chem. 32: 937. doi:10.1039/B803953B.http://pubs.rsc.org/en/Content/ArticleLanding/2008/NJ/b803953b
- ↑ S. Horike, M. Dinca, K. Tamaki and J. R. Long, (2008). "Size-Selective Lewis-Acid Catalysis in a Microporous Metal-Organic Framework with Exposed Mn2+ Coordination Sites". J. Am. Chem. Soc. 130: 5854. doi:10.1021/ja800669j http://pubs.acs.org/doi/abs/10.1021/ja800669j
- ↑ Jiří Čejka (ed.) "Metal-Organic Frameworks Applications from Catalysis to Gas Storage" Wiley-VCH, Weinheim, 2011. 392 pp. ISBN 978-3-527-32870-3
- ↑ Czaja, Alexander U.; Trukhan, Natalia; Müller, Ulrich (2009). "Industrial applications of metal-organic frameworks". Chemical Society Reviews 38 (5): 1284–1293. doi:10.1039/b804680h. PMID 19384438. http://pubs.rsc.org/en/Content/ArticleLanding/2009/CS/b804680h
- ↑ Cheetham, Rao, and Feller. Structural diversity and chemical trends in hybrid inorganic-organic framework materials. Chem. Comm. 46 (2006) 4780. doi:10.1039/b610264f
- ↑ 'CP and MOF Project. May 09, 2010. Retrieved on May 09, 2010. http://www.iupac.org/nc/home/projects/project-db/project-details.html?tx_wfqbe_pi1%5bproject_nr%5d=2009-012-2-200 เก็บถาวร 2013-09-17 ที่ เวย์แบ็กแมชชีน
- ↑ Batten, Stuart R.; Champness, Neil R.; Chen, Xiao-Ming; Garcia-Martinez, Javier; Kitagawa, Susumu; Öhrström, Lars; O'Keeffe, Michael; Suh, Myunghyun P. et al. (2012). "Coordination polymers, metal–organic frameworks and the need for terminology guidelines". CrystEngComm (RSC). doi:10.1039/C2CE06488J. http://pubs.rsc.org/en/Content/ArticleLanding/2012/CE/c2ce06488j
- ↑ Furukawa, H; Ko, N; Go, YB; Aratani, N; Choi, SB; Choi, E; ; Snurr, RQ; O'Keeffe, M; Kim, J; Yaghi, OM; "Ultrahigh Porosity in Metal-Organic Frameworks". Science. 2010, 329, pp 424-428. DOI: 10.1126/science.1192160 http://www.sciencemag.org/content/329/5990/424
- ↑ Mendoza-Cortes JL; Han SS; Furukawa H; Yaghi OM; Goddard, WA; "Adsorption Mechanism and Uptake of Methane in Covalent Organic Frameworks: Theory and Experiment". J. Phys. Chem. A, 2010, 114, pp 10824–10833.DOI: 10.1021/jp1044139 http://pubs.acs.org/doi/abs/10.1021/jp1044139
- ↑ Uemura, T.; Kitaura, R.; Ohta, Y.; Nagaoka, M.; Kitagawa, S. (2006). "Nanochannel-Promoted Polymerization of Substituted Acetylenes in Porous Coordination Polymers". Angew. Chem. Int. Ed. 45: 4112–4116. doi:10.1002/anie.200600333 http://onlinelibrary.wiley.com/doi/10.1002/anie.200600333/abstract;jsessionid=6AC3931A23525A4680D96B4E64DC8D5E.d03t03
- ↑ S. T. Wu, Y. R. Wu, Q. Q. Kang, H. Zhang, L. S. Long, Z. P. Zheng, R. B. Huang, L. S. Zheng (2007). "Chiral Symmetry Breaking by Chemically Manipulating Statistical Fluctuation in Crystallization". Angew. Chem. Int. Ed. 46: 8475. doi:10.1002/anie.200703443 http://onlinelibrary.wiley.com/doi/10.1002/anie.200703443/abstract