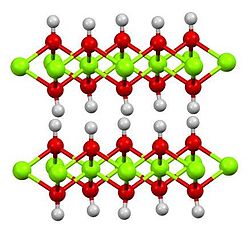
แมกนีเซียมไฮดรอกไซด์

| |
| |
| ชื่อ | |
|---|---|
| IUPAC name
Magnesium hydroxide
| |
| ชื่ออื่น
Milk of magnesia
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.013.792 |
| EC Number |
|
| เลขอี | E528 (acidity regulators, ...) |
| 485572 | |
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| Mg(OH)2 | |
| มวลโมเลกุล | 58.3197 ก./โมล |
| ลักษณะทางกายภาพ | ของแข็งสีขาว |
| กลิ่น | ไร้กลิ่น |
| ความหนาแน่น | 2.3446 ก./ซม3 |
| จุดหลอมเหลว | 350 องศาเซลเซียส (662 องศาฟาเรนไฮต์; 623 เคลวิน) decomposes |
| |
| Solubility product, Ksp | 5.61×10−12 |
| −22.1·10−6 ซม.3/mol | |
ดัชนีหักเหแสง (nD)
|
1.559[1] |
| โครงสร้าง | |
| รูปหกเหลี่ยม, hP3[2] | |
| P3m1 No. 164 | |
| อุณหเคมี | |
ความจุความร้อน (C)
|
77.03 J/mol·K |
Std molar
entropy (S⦵298) |
64 J·mol−1·K−1[3] |
Std enthalpy of
formation (ΔfH⦵298) |
−924.7 kJ·mol−1[3] |
พลังงานเสรีกิบส์ (ΔfG⦵)
|
−833.7 kJ/mol |
| เภสัชวิทยา | |
| A02AA04 (WHO) G04BX01 | |
| ความอันตราย | |
| NFPA 704 (fire diamond) | |
| จุดวาบไฟ | ไม่ไวไฟ |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LD50 (median dose)
|
8500 ม.ก./กก. (หนู, ทางปาก) |
| เอกสารข้อมูลความปลอดภัย (SDS) | External MSDS |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แอนไอออนอื่น ๆ
|
แมกนีเซียมออกไซด์ |
แคทไอออนอื่น ๆ
|
|
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
แมกนีเซียมไฮดรอกไซด์ (อังกฤษ: magnesium hydroxide) เป็นสารประกอบอนินทรีย์ซึ่งมีสูตรเคมี Mg(OH)2 และมีอยู่ตามธรรมชาติโดยเป็นแร่บรูไซต์ (brucite) เป็นของแข็งสีขาวละลายน้ำได้น้อย (Ksp=5.61×10−12)[4] เป็นองค์ประกอบสามัญของยาลดกรด เช่น มิลก์ออฟแมกนีเซีย (milk of magnesia) พร้อมทั้งยาระบาย
การปรุง
[แก้]การผสมเกลือแมกนีเซียมหลายอย่างกับน้ำด่างจะทำให้ Mg(OH)2 ตกตะกอนเป็นของแข็ง คือ
- Mg2+ + 2 OH− → Mg (OH)2
การผลิตในระดับอุตสหากรรมจะผสมน้ำทะเลกับแคลเซียมไฮดรอกไซด์ (น้ำปูนใส คือ Ca(OH)2) น้ำทะเล 600 ลูกบาศก์เมตรจะได้ Mg(OH)2 ประมาณหนึ่งตัน เพราะ Ca(OH)2 ละลายในน้ำได้ดีกว่า Mg(OH)2 จึงตกตะกอน คือ[5]
- Mg2+ + Ca(OH)2 → Mg(OH)2 + Ca2+
การใช้
[แก้]สารตั้งต้นของ MgO
[แก้]Mg(OH)2 โดยมากที่ผลิตในระดับอุตสาหกรรม และส่วนน้อยอีกจำนวนหนึ่งที่ได้จากเหมืองแร่ จะแปรเป็นแมกนีเซียมออกไซด์ (MgO) หรือแมกนีเซีย ซึ่งมีค่าเพราะนำไฟฟ้าไม่ได้แต่นำความร้อนได้ดีเยี่ยม[5]
อนามัย
[แก้]เมแทบอลิซึม
[แก้]เมื่อคนไข้ทานยาแมกนีเซียมไฮดรอกไซด์ สารแขวนลอยในยาจะเข้าไปในกระเพาะ ขึ้นอยู่กับว่าทานมากแค่ไหน ผลที่เป็นไปได้จะมีสองอย่าง
เมื่อทานเป็นยาลดกรด ขนาดที่ใช้จะราว ๆ 0.5-1.5 กรัมในผู้ใหญ่ และมีฤทธิ์ทำให้กรดในกระเพาะกลายเป็นกลางโดยตรง คือ ไอออนไฮดรอกไซด์จาก Mg(OH)2 จะรวมกับไอออน H+ จากกรดไฮโดรคลอริกซึ่งสร้างโดยเซลล์ parietal ในกระเพาะแล้วกลายเป็นน้ำ
เมื่อทานเป็นยาระบาย ขนาดที่ใช้จะราว ๆ 2-5 กรัม และออกฤทธิ์หลายอย่าง อย่างแรก เพราะ Mg2+ ดูดซึมออกจากทางเดินอาหารได้ไม่ดี ดังนั้น มันจึงดึงน้ำจากเนื้อเยื่อรอบ ๆ ผ่านกระบวนการออสโมซิส ซึ่งไม่เพียงแค่เพิ่มน้ำที่ทำให้อุจจาระนิ่ม แต่ยังเพิ่มปริมาตรของอุจจาระในลำไส้ (intraluminal volume) ซึ่งกระตุ้นให้ลำไส้บีบตัว (motility) โดยธรรมชาติ อนึ่ง Mg2+ เป็นเหตุให้ร่างกายหลั่งฮอร์โมนเพปไทด์ cholecystokinin (CCK) ซึ่งทำให้ช่องทางเดินอาหารสะสมน้ำ อิเล็กโทรไลต์ และเพิ่มการบีบตัวของลำไส้ แม้บางที่อาจอ้างไอออนไฮดรอกไซด์ว่ามีฤทธิ์ด้วย แต่มันก็ไม่มีบทบาทสำคัญต่อฤทธิ์ระบายของแมกนีเซียมไฮดรอกไซด์ เพราะสารละลายที่เป็นด่าง (คือสารละลายไอออนไฮดรอกไซด์) ไม่มีฤทธิ์ระบาย ส่วนสาระละลาย Mg2+ ที่เป็นกรด เช่นแมกนีเซียมซัลเฟต (MgSO4) จะมีฤทธิ์ระบายอย่างมีกำลังโดยเทียบกันได้โมลต่อโมล[6]
ลำไส้ดูดซึมแมกนีเซียมจากแมกนีเซียมไฮดรอกไซด์เพียงแค่เล็กน้อย ยกเว้นเมื่อร่างกายขาดแมกนีเซียม อย่างไรก็ดี ไตเป็นอวัยวะหลักที่ขับแมกนีเซียมออก ดังนั้น โดยทฤษฎี ผู้ที่มีไตวายที่ใช้ยาเป็นประจำทุกวันนาน ๆ อาจเกิดสภาวะแมกนีเซียมเกินในเลือด (hypermagnesemia) ยาที่ไม่ได้ดูดซึมจะขับออกทางอุจจาระ ส่วนที่ดูดซึมจะขับออกทางปัสสาวะอย่างรวดเร็ว[7]
ประวัติ
[แก้]ในปี 1818 นักประดิษฐ์ชาวอเมริกัน John Callen ได้รับสิทธิบัตรเพื่อแมกนีเซียมไฮดรอกไซด์[8] ในปี 1829 แพทย์ชาวอังกฤษ (Sir James Murray) ได้ใช้ "สารละลายเข้มข้นประกอบด้วยแมกนีเซีย"[9] เพื่อรักษาอาการปวดท้องของข้าหลวงใหญ่แห่งไอร์แลนด์ (Marquis of Anglesey) ซึ่งประสบความสำเร็จ (ดังที่ได้โฆษณาในออสเตรเลียและรับรองโดยราชวิทยาลัยศัลยแพทย์ในปี 1838)[10] จนกระทั่งหมอได้รับตำแหน่งเป็นแพทย์ประจำข้าหลวงใหญ่แห่งไอร์แลนด์ 3 ท่าน แล้วต่อมาได้รับสถาปนาให้เป็นอัศวิน ผลิตภัณฑ์ของเขาต่อมาได้สิทธิบัตร 2 ปีหลังจากเขาเสียชีวิตในปี 1873[11]
ส่วนคำว่า มิลก์ออฟแมกนีเซีย (นมแมกนีเซีย) เภสัชกรชาวอังกฤษ คือ Charles Henry Phillips ได้ใช้เป็นครั้งแรกในปี 1872 เป็นสารแขวนลอยแมกนีเซียมไฮดรอกไซด์ในน้ำที่มีความเข้มข้นเชิงมวล (mass concentration) ราว 8%w/v[12] ซึ่งขายในยี่ห้อ Phillips' Milk of Magnesia เป็นยา
แม้บริษัท GlaxoSmithKline ครั้งหนึ่งอาจจะเป็นเจ้าของชื่อการค้า "Milk of Magnesia" และ "Phillips' Milk of Magnesia" แต่ทะเบียนของสำนักงานสิทธิบัตรและเครื่องหมายการค้าสหรัฐ (USPTO) ก็แสดงว่า ชื่อทั้งสอง[13][14] อยู่ในกรรมสิทธิ์ของบริษัท Bayer ตั้งแต่ปี 1995 ในสหราชอาณาจักร ชื่อสามัญของ "Milk of Magnesia" และ "Phillips' Milk of Magnesia" ก็คือ "Cream of Magnesia" (ครีมแมกนีเซีย)
ยาและผลิตภัณฑ์รักษาความสะอาด
[แก้]แมกนีเซียมไฮดรอกไซด์วางตลาดขายเป็นยาเคี้ยวได้ ยาแคปซูล ยาน้ำโดยเป็นสารแขวนลอย โดยบางครั้งจะมีรสต่าง ๆ เป็นยาลดกรดเพื่อทำกรดกระเพาะอาหารให้เป็นกลาง บรรเทาอาหารไม่ย่อย และอาการแสบร้อนกลางอก เป็นยาระบายเพื่อบรรเทาอาการท้องผูก เมื่อใช้เป็นยาลดกรด ฤทธิ์ทางออสโมซิสของแมกนีเซียจะดึงน้ำออกจากร่างกาย การทานยาเป็นจำนวนมากอาจทำให้ท้องร่วง ทำให้ร่างกายหมดโพแทสเซียม และบางครั้งทำให้เป็นตะคริว[15]
ผลิตภัณฑ์แมกนีเซียมไฮดรอกไซด์บางอย่างที่ขายเพื่อลดกรด (เช่นยี่ห้อ Maalox) จะใช้สูตรซึ่งลดฤทธิ์ระบายที่ไม่ต้องการโดยผสมกับอะลูมิเนียมไฮดรอกไซด์ซึ่งยับยั้งการบีบตัวของกล้ามเนื้อเรียบในทางเดินอาหาร[16] ดังนั้น จึงถ่วงดุลการบีบตัวที่เกิดจากฤทธิ์ออสโมซิสของแมกนีเซียมไฮดรอกไซด์
แมกนีเซียมไฮดรอกไซด์ยังเป็นองค์ประกอบอย่างหนึ่งของสารต้านการหลั่งเหงื่ออีกด้วย[17] และมีผลดีต่อปากอักเสบเมื่อใช้ทา[18]
อื่น ๆ
[แก้]การบำบัดน้ำเสีย
[แก้]แป้งแมกนีเซียมไฮดรอกไซด์ใช้บำบัดน้ำเสียที่เป็นกรดให้เป็นกลางในทางอุตสาหกรรม[19] และใช้เป็นองค์ประกอบส่วนหนึ่งในการสร้างปะการังเทียมด้วยเทคนิก Biorock
สารหน่วงไฟ
[แก้]แมกนีเซียมไฮดรอกไซด์ในรูปแบบแร่บรูไซต์ตามธรรมชาติใช้เป็นสารหน่วงไฟ โดยสังเคราะห์ขึ้นโดยมาก[20] เหมือนกับอะลูมิเนียมไฮดรอกไซด์ แมกนีเซียมไฮดรอกไซด์ที่เป็นของแข็งจะมีคุณสมบัติห้ามควันและหน่วงไฟ คุณสมบัติเช่นนี้มาจากการสลายตัวแบบดูดซับความร้อนที่อุณหภูมิ 332 องศาเซลเซียส คือ
- Mg(OH)2 → MgO + H2O
ความร้อนที่ดูดซึมเนื่องด้วยปฏิกิริยา จะหน่วงการติดไฟของสารอื่น ๆ อนึ่ง น้ำที่ปล่อยออกยังทำแก๊สที่ติดไฟได้ให้เจือจาง การใช้สามัญรวมการใส่แมกนีเซียมไฮดรอกไซด์เข้าในปลอกสายเคเบิล (เช่น ในรถยนต์คุณภาพสูง เรือดำน้ำ เครื่องบินแอร์บัส เอ380 และเครื่องเพลย์สเตชัน 4 เป็นต้น) ในฉนวนพลาสติก ในวัสดุมุงหลังคา (เช่น ที่สนามกีฬาโอลิมปิกลอนดอน) และในตัวเคลือบหน่วงไฟต่าง ๆ สารผสมเป็นแร่อื่น ๆ ที่ใช้ในการหน่วงไฟคล้าย ๆ ก็คือ huntite บวกกับ hydromagnesite ที่มีตามธรรมชาติ[21][22][23][24][25]
วิทยาแร่
[แก้]
บรูไซต์ ซึ่งเป็นรูปแบบแร่ของ Mg(OH)2 ที่พบอย่างสามัญตามธรรมชาติ ก็เกิดด้วยในแร่ดิน (clay mineral) แบบ 1:2:1 เป็นต้น และในคลอไรต์ โดยจะอยู่ในชั้นในระหว่าง ๆ ที่ปกติเป็นแคตไอออนแบบเวเลนซีหนึ่ง (monovalent) หรือสอง (divalent) เช่น Na+, K+, Mg2+ และ Ca2+ ดังนั้น ชั้นในระหว่าง ๆ ของคลอไรต์จึงประสานกันด้วยบรูไซต์ซึ่งไม่สามารถขยายหรือหดตัวลงได้
เมื่อแคตไอออน Mg2+ บางส่วนแทนที่ด้วย Al3+ บรูไซต์ก็จะมีประจุบวก ซึ่งเป็นมูลฐานทางโครงสร้างของ layered double hydroxide (LDH) แร่ LDH เช่น ไฮโดรทัลไซต์ เป็นตัวดูดแอนไอออนที่มีฤทธิ์แรง แต่ก็มีค่อนข้างน้อยตามธรรมชาติ
บรูไซต์อาจตกผลึกในซีเมนต์และคอนกรีตเมื่ออยู่กับน้ำทะเล Mg2+ เป็นแคตไอออนซึ่งสามัญที่สุดเป็นอันดับสองในน้ำทะเล คือต่อจาก Na+ และก่อนหน้า Ca2+ แต่เพราะเป็นแร่ที่ขยายตัวได้ จึงเป็นเหตุของความเค้นแบบดึงเนื่องจากการขยายปริมาตรเฉพาะที่ภายในคอนกรีต ซึ่งทำให้คอนกรีตร้าวและแตก ทำให้คอนกรีตเสื่อมเร็วขึ้นในน้ำทะเล
โดยทำนองเดียวกัน โดโลสโตน (dolostone) จึงไม่สามารถใช้เป็นวัสดุทำคอนกรีตได้ เพราะปฏิกิริยาของแมกนีเซียมคาร์บอเนตกับไฮดรอกไซด์ที่เป็นอิสระและพบในน้ำเมื่อทำซีเมนต์ ก็จะก่อบรูไซต์ที่ขยายตัวได้เช่นกัน คือ
- MgCO3 + 2 NaOH → Mg(OH)2 + Na2CO3
นี่เป็นปฏิกิริยาหนึ่งอย่างในสองอย่างแบบ alkali-aggregate reaction (AAR) และเรียกว่า alkali-carbonate reaction
เชิงอรรถและอ้างอิง
[แก้]- ↑ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Enoki, Toshiaki; Tsujikawa, Ikuji (1975). "Magnetic Behaviours of a Random Magnet, NipMg (1-p) (OH2)". J. Phys. Soc. Jpn. 39 (2): 317–323. doi:10.1143/JPSJ.39.317.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 3.0 3.1 Zumdahl, Steven S. (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. p. A22. ISBN 0-618-94690-X.
- ↑ Handbook of Chemistry and Physics (76th ed.). CRC Press. ISBN 0849305969.
- ↑ 5.0 5.1 Seeger, Margarete; Otto, Walter; Flick, Wilhelm; Bickelhaupt, Friedrich; Akkerman, Otto S, "Magnesium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_595.pub2
{{citation}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Tedesco, FJ; DiPiro, JT (1985). "Laxative use in constipation". Am. J. Gastroenterol. 80 (4): 303–9. PMID 2984923.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "magnesium hydroxide". Global Library of Women's Medicine. เก็บจากแหล่งเดิมเมื่อ 2018-08-28. สืบค้นเมื่อ 2018-09-26.
- ↑ "Patent USX2952 - Magnesia, medicated, liquid". Google Patents. เก็บจากแหล่งเดิมเมื่อ 2018-09-26.
- ↑ Hordern, Michael (1993). A world elsewhere: the autobiography of Sir Michael Hordern. Michael O'Mara. pp. 2. ISBN 978-1854791887.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Sir James Murray's condensed solution of fluid magnesia". The Sydney Morning Herald. Vol. 21 no. 2928. 1846-10-07. p. 1, column 4.
- ↑ "Ulster History. Sir James Murray - Inventor of Milk of Magnesia. 1788 to 1871". 2005-02-24. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-06-05.
- ↑ "FAQ - When was Phillips' Milk of Magnesia introduced?". phillipsrelief.com. เก็บจากแหล่งเดิมเมื่อ 2017-06-22. สืบค้นเมื่อ 2016-07-04.
- ↑ "Milk of Magnesia". USPTO.
- ↑ "Phillips' Milk of Magnesia". USPTO.
- ↑ "Magnesium Hydroxide". Everyday Health. เก็บจากแหล่งเดิมเมื่อ 2017-08-04. สืบค้นเมื่อ 2018-10-13.
- ↑ Washington, Neena (1991-08-02). Antacids and Anti Reflux Agents. Boca Raton, FL: CRC Press. p. 10. ISBN 0-8493-5444-7.
- ↑ "Milk of Magnesia Makes Good Antiperspirant". คลังข้อมูลเก่าเก็บจากhttp://www.peoplespharmacy.com/archives/pharmacy_qa/milk_of_magnesia_makes_good_antiperspirant.asp แหล่งเดิมเมื่อ 2007-04-02. สืบค้นเมื่อ 2018-10-13.
{{cite web}}: ตรวจสอบค่า|url=(help) - ↑ "Canker sores". 2009-02-01. เก็บจากแหล่งเดิมเมื่อ 2018-08-18.
- ↑ Gibson, Aileen; Maniocha, Michael (2004-08-12). "White Paper: The Use Of Magnesium Hydroxide Slurry For Biological Treatment Of Municipal and Industrial Wastewater". wateronline.com. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-03-15.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Rothon, RN (2003). Particulate Filled Polymer Composites. Shrewsbury, UK: Rapra Technology. pp. 53–100.
- ↑
Hollingbery, LA; Hull, TR (2010). "The Thermal Decomposition of Huntite and Hydromagnesite - A Review". Thermochimica Acta. 509 (1–2): 1–11. doi:10.1016/j.tca.2010.06.012.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Hollingbery, LA; Hull, TR (2010). "The Fire Retardant Behaviour of Huntite and Hydromagnesite - A Review". Polymer Degradation and Stability. 95 (12): 2213–2225. doi:10.1016/j.polymdegradstab.2010.08.019.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Hollingbery, LA; Hull, TR (2012). "The Fire Retardant Effects of Huntite in Natural Mixtures with Hydromagnesite". Polymer Degradation and Stability. 97 (4): 504–512. doi:10.1016/j.polymdegradstab.2012.01.024.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Hollingbery, LA; Hull, TR (2012). "The Thermal Decomposition of Natural Mixtures of Huntite and Hydromagnesite". Thermochimica Acta. 528: 45–52. doi:10.1016/j.tca.2011.11.002.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Hull, TR; Witkowski, A; Hollingbery, LA (2011). "Fire Retardant Action of Mineral Fillers". Polymer Degradation and Stability. 96 (8): 1462–1469. doi:10.1016/j.polymdegradstab.2011.05.006.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)

