อันดับพันธะ
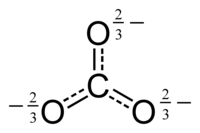
อันดับพันธะ (อังกฤษ: Bond Order; B.O.) เป็นตัวเลขที่แสดงถึงจำนวนพันธะเคมีระหว่างอะตอมสองอะตอม เช่น พันธะโคเวเลนต์ในโมเลกุลไนโตรเจน N≡N อันดับพันธะเท่ากับ 3 ในขณะที่พันธะในโมเลกุลอะเซทิลีน H−C≡C−H พันธะระหว่างอะตอมของคาร์บอนมีอันดับพันธะเท่ากับ 3 และพันธะ C−H มีอันดับพันธะเท่ากับ 1 เป็นต้น อันดับพันธะเป็นตัวชี้วัดความเสถียร (Stability) ของพันธะและมีความสัมพันธ์กับความยาวพันธะอีกด้วย
อย่างไรก็ตาม อันดับพันธะไม่จำเป็นต้องเป็นเลขจำนวนเต็ม ซึ่งในทฤษฎีพันธะเวเลนซ์ (Valence Bond Theory)สามารถคำนวณอันดับพันธะ (B.O.) ได้โดยพิจารณาจำนวนอิเล็กตรอนในออร์บิทัลสร้างพันธะ (Number of Bonding Electrons)และจำนวนอิเล็กตรอนในออร์บิทัลต้านการสร้างพันธะ (Number of Antibonding Electrons) ดังสมการ
ตัวอย่างการคำนวณอันดับพันธะ
[แก้]
จากภาพ โมเลกุลไฮโดรเจนมีอิเล็กตรอนบรรจุในออร์บิทัลสร้างพันธะ 2 ตัวและไม่มีอิเล็กตรอนในออร์บิทัลต้านการสร้างพันธะ ดังนั้น อันดับพันธะในโมเลกุลไฮโดรเจนจึงเท่ากับ 1
อันดับพันธะ 0.5 พบในโมเลกุลของ H+
2(มีความยาวพันธะ เท่ากับ 106 pm และพลังงานพันธะ เท่ากับ 269 kJ/mol) และโมเลกุลของ He+
2 (มีความยาวพันธะ เท่ากับ 108 pm และพลังงานพันธะ เท่ากับ 251 kJ/mol) อันดับพันธะที่มากขึ้นจะแสดงถึงความแข็งแรงของพันธะที่มากขึ้นและเมื่ออันดับพันธะมากขึ้นความยาวของพันธะจะลดลงด้วย


