สมบัติการระเหยง่าย

สมบัติการระเหยง่าย หรือ ความระเหยง่าย ใน เคมี เป็นคุณสมบัติของวัสดุที่อธิบายถึงความพร้อมของสารที่จะเกิดการระเหย ในอุณหภูมิและความดันที่กำหนด สารที่มีความผันผวนสูงจะมีแนวโน้มที่จะอยู่ในรูปของไอมากกว่า ขณะที่สารที่มีความผันผวนต่ำจะมีแนวโน้มที่จะอยู่ในรูปของเหลวหรือของแข็ง ความผันผวนยังสามารถอธิบายถึงแนวโน้มของไอที่จะควบแน่นเป็นของเหลวหรือของแข็งได้อีกด้วย สารที่มีความผันผวนต่ำจะควบแน่นจากไอได้ง่ายกว่าสารที่มีความผันผวนสูง[1] ความแตกต่างของความผันผวนสามารถสังเกตได้โดยการเปรียบเทียบว่า สารในกลุ่มนั้นระเหยเร็วเพียงใด (หรือการระเหิด) ในกรณีของของแข็ง เมื่อสัมผัสกับบรรยากาศ สารที่มีความผันผวนสูง เช่น แอลกอฮอล์ไอโซโพรพานอล จะระเหยอย่างรวดเร็ว ขณะที่สารที่มีความผันผวนต่ำ เช่น น้ำมันพืช จะคงอยู่ในสภาพควบแน่น[2] โดยทั่วไปแล้ว ของแข็งจะระเหยได้น้อยกว่าของเหลวมาก แต่ก็มีข้อยกเว้นบางประการ ของแข็งที่ระเหิด (เปลี่ยนจากของแข็งเป็นไอโดยตรง) เช่น น้ำแข็งแห้ง (คาร์บอนไดออกไซด์ ที่เป็นของแข็ง ) หรือไอโอดีนสามารถระเหิดได้ในอัตราที่ใกล้เคียงกับของเหลวบางชนิดภายใต้สภาวะมาตรฐาน สามารถระเหยในอัตราที่ใกล้เคียงกับของเหลวบางชนิดภายใต้สภาวะมาตรฐาน[3]
คำอธิบาย
[แก้]ความผันผวนไม่มีค่าตัวเลขที่กำหนดไว้อย่างชัดเจน แต่โดยทั่วไปจะอธิบายด้วยความดันไอหรือจุดเดือด (สำหรับของเหลว) ความดันไอที่สูงบ่งบอกถึงความผันผวนสูง ขณะที่จุดเดือดที่สูงบ่งบอกถึงความผันผวนต่ำ ความดันไอและจุดเดือดมักจะแสดงในตารางและกราฟที่ใช้ในการเปรียบเทียบสารเคมีที่สนใจ ข้อมูลเกี่ยวกับความผันผวนมักได้มาจากการทดลองภายใต้ช่วงอุณหภูมิและความดันต่างๆ
ความดันไอ
[แก้]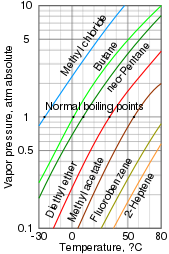
ความดันไอเป็นการวัดว่าเฟสที่อยู่ในสภาพควบแน่นสามารถเปลี่ยนเป็นไอได้ง่ายเพียงใดที่อุณหภูมิหนึ่งๆ สารที่อยู่ในภาชนะปิดซึ่งเริ่มต้นด้วยภาวะสูญญากาศ (ไม่มีอากาศอยู่ภายใน) จะเติมพื้นที่ว่างด้วยไออย่างรวดเร็ว หลังจากที่ระบบถึงจุดสมดุลและอัตราการระเหยเท่ากับอัตราการควบแน่นแล้ว ความดันไอสามารถวัดได้ การเพิ่มอุณหภูมิจะเพิ่มปริมาณไอที่เกิดขึ้นและทำให้ความดันไอเพิ่มขึ้น ในสารผสม แต่ละสารจะมีส่วนในการสร้างความดันไอรวมของสารผสม โดยที่สารที่มีความผันผวนสูงกว่าจะมีส่วนมากกว่า
จุดเดือด
[แก้]จุดเดือดคืออุณหภูมิที่ความดันไอของของเหลวเท่ากับความดันโดยรอบ ทำให้ของเหลวระเหยอย่างรวดเร็วหรือเดือด จุดเดือดมีความเกี่ยวข้องอย่างใกล้ชิดกับความดันไอ แต่จะขึ้นอยู่กับความดัน จุดเดือดปกติคือจุดเดือดที่ความดันบรรยากาศ แต่สามารถรายงานได้ที่ความดันที่สูงหรือต่ำกว่าด้วย[3]
ปัจจัยที่มีส่วนร่วม
[แก้]แรงระหว่างโมเลกุล
[แก้]
ปัจจัยสำคัญที่ส่งผลต่อความผันผวนของสารคือความแข็งแรงของปฏิกิริยาระหว่างโมเลกุล แรงดึงดูดระหว่างโมเลกุลเป็นสิ่งที่ยึดเหนี่ยววัสดุเข้าด้วยกัน และวัสดุที่มีแรงระหว่างโมเลกุลที่แข็งแรงกว่า เช่น ของแข็งส่วนใหญ่ มักจะมีความผันผวนต่ำ เอทานอลและไดเมทิลอีเทอร์ สารเคมีสองชนิดที่มีสูตรเดียวกัน (C2H6O) มีความผันผวนต่างกันเนื่องจากปฏิกิริยาที่เกิดขึ้นระหว่างโมเลกุลในเฟสของเหลวต่างกัน โมเลกุลเอทานอลสามารถสร้างพันธะไฮโดรเจน ได้ ในขณะที่โมเลกุลไดเมทิลอีเธอร์ทำไม่ได้[4] ส่งผลให้เกิดแรงดึงดูดระหว่างโมเลกุลของเอทานอลมีความแข็งแรงมากกว่า ทำให้เอทานอลเป็นสารที่มีความผันผวนน้อยกว่าสารทั้งสอง
น้ำหนักโมเลกุล
[แก้]โดยทั่วไป ความผันผวนมักจะลดลงเมื่อมวลโมเลกุลเพิ่มขึ้น เนื่องจากโมเลกุลที่ใหญ่กว่าสามารถมีส่วนร่วมในการสร้างพันธะระหว่างโมเลกุลได้มากขึ้น[5] แม้ว่าปัจจัยอื่นๆ เช่น โครงสร้างและความมีขั้วของโมเลกุลจะมีบทบาทสำคัญอย่างมากก็ตาม ผลของมวลโมเลกุลสามารถแยกออกบางส่วนได้โดยการเปรียบเทียบสารเคมีที่มีโครงสร้างคล้ายกัน (เช่น เอสเทอร์ เเอลเคน เป็นต้น) ตัวอย่างเช่น แอลเคนแบบเส้นตรงจะแสดงความผันผวนที่ลดลงเมื่อจำนวนคาร์บอนในสายโซ่เพิ่มขึ้น
การประยุกต์ใช้งาน
[แก้]การกลั่น
[แก้]
ความรู้เกี่ยวกับความระเหยมักมีประโยชน์ในการแยกส่วนประกอบจากสารผสม เมื่อสารผสมที่ประกอบด้วยสารหลายชนิดที่มีระดับความระเหยแตกต่างกัน สามารถปรับอุณหภูมิและความดันให้เหมาะสมเพื่อให้ส่วนประกอบที่มีความระเหยสูงเปลี่ยนเป็นไอ ในขณะที่สารที่มีความระเหยต่ำจะยังคงอยู่ในสถานะของเหลวหรือของแข็ง จากนั้นไอที่เกิดขึ้นใหม่สามารถทิ้งหรือควบแน่นลงในภาชนะแยกต่างหาก เมื่อรวบรวมไอแล้ว กระบวนการนี้เรียกว่า การกลั่น[6]
กระบวนการการกลั่นแบบเศษส่วน ซึ่งใช้ในการการกลั่นน้ำมันปิโตรเลียม ช่วยให้สามารถแยกสารเคมีที่มีความระเหยแตกต่างกันในขั้นตอนเดียว น้ำมันดิบ ที่เข้าสู่โรงกลั่นประกอบด้วยสารเคมีที่มีประโยชน์หลายชนิดที่ต้องแยกออก น้ำมันดิบไหลเข้าสู่คอลัมน์การกลั่นและถูกทำให้ร้อน ซึ่งทำให้ส่วนประกอบที่มีความระเหยสูง เช่น บิวเทน และน้ำมันก๊าด กลายเป็นไอ ไอเหล่านี้จะเคลื่อนที่ขึ้นไปในคอลัมน์และสัมผัสกับพื้นผิวเย็น ทำให้มันควบแน่นและถูกเก็บรวบรวม สารเคมีที่มีความระเหยสูงที่สุดจะควบแน่นที่ด้านบนของคอลัมน์ ในขณะที่สารเคมีที่มีความระเหยน้อยที่สุดจะควบแน่นในส่วนล่างสุด[1] ด้านขวาคือภาพที่แสดงการออกแบบของคอลัมน์การกลั่น
ความแตกต่างในความผันผวนระหว่างน้ำและเอทานอลนั้นถูกนำมาใช้ในการกลั่น แอลกอฮอล์ สำหรับดื่ม มาโดยตลอด เพื่อเพิ่มความเข้มข้นของเอทานอลในผลิตภัณฑ์ ผู้ผลิตแอลกอฮอล์จะให้ความร้อนกับส่วนผสมแอลกอฮอล์เริ่มต้นจนถึงอุณหภูมิที่เอทานอลส่วนใหญ่จะระเหยไปในขณะที่น้ำส่วนใหญ่จะยังคงเป็นของเหลว จากนั้นไอเอทานอลจะถูกเก็บรวบรวมและควบแน่นในภาชนะแยกต่างหาก ส่งผลให้ผลิตภัณฑ์มีความเข้มข้นมากขึ้น[7]
น้ำหอม
[แก้]ความระเหยเป็นปัจจัยสำคัญเมื่อการออกแบบน้ำหอม มนุษย์รับรู้กลิ่นเมื่อไอระเหยน้ำหอมสัมผัสกับตัวรับในจมูก ส่วนผสมที่ระเหยเร็วหลังจากการทา จะปล่อยไอหอมออกมาเป็นระยะเวลาสั้นๆ ก่อนที่น้ำมันจะระเหยออกไป ส่วนผสมที่ระเหยช้าสามารถอยู่บนผิวหนังได้เป็นสัปดาห์หรือแม้แต่เดือน แต่ไม่อาจปล่อยไอหอมได้เพียงพอเพื่อให้ได้กลิ่นที่เข้มข้น เพื่อป้องกันปัญหาเหล่านี้ นักออกแบบน้ำหอมจะพิจารณาความระเหยของน้ำมันหอมระเหยและส่วนผสมอื่นๆ ในการสร้างน้ำหอมอย่างรอบคอบ อัตราการระเหยที่เหมาะสมจะได้รับโดยการปรับปริมาณของส่วนผสมที่มีความระเหยสูงและที่ไม่ระเหย[8]
อ้างอิง
[แก้]- ↑ 1.0 1.1 Felder, Richard (2015). Elementary Principles of Chemical Processes. John Wiley & Sons. pp. 279–281. ISBN 978-1-119-17764-7.
- ↑ Koretsky, Milo D. (2013). Engineering and Chemical Thermodynamics. John Wiley & Sons. pp. 639–641.
- ↑ 3.0 3.1 Zumdahl, Steven S. (2007). Chemistry. Houghton Mifflin. pp. 460-466. ISBN 978-0-618-52844-8.
- ↑ Atkins, Peter (2013). Chemical Principles. New York: W.H. Freeman and Company. pp. 368–369. ISBN 978-1-319-07903-1.
- ↑ "Hydrocarbon boiling points". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 7 February 2023. สืบค้นเมื่อ 28 April 2021.
- ↑ Armarego, Wilfred L. F. (2009). Purification of Laboratory Chemicals. Elsevier. pp. 9-12. ISBN 978-1-85617-567-8.
- ↑ Kvaalen, Eric. "Alcohol Distillation: Basic Principles, Equipment, Performance Relationships, and Safety". Purdue.
- ↑ Sell, Charles (2006). The Chemistry of Fragrances. UK: The Royal Society of Chemistry. pp. 200-202. ISBN 978-0-85404-824-3.
