การสร้างเม็ดเลือดแดง
บทความนี้อาจต้องการตรวจสอบต้นฉบับ ในด้านไวยากรณ์ รูปแบบการเขียน การเรียบเรียง คุณภาพ หรือการสะกด คุณสามารถช่วยพัฒนาบทความได้ |
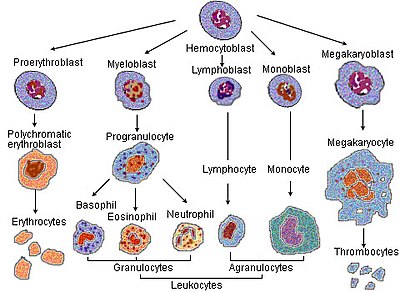
การสร้างเม็ดเลือดแดง (อังกฤษ: erythropoiesis) คือ การผลิตเม็ดเลือดแดง สามารถถูกกระตุ้นได้ในภาวะ O2 ลดต่ำลงในกระแสเลือด ซึ่งจะถูกตรวจสอบโดยไตและจะหลั่งฮอร์โมน erythropoietin ออกมาก[2] ฮอร์โมนตัวนี้จะไปกระตุ้นการเพิ่มจำนวน (proliferation) และการเปลี่ยนสภาพ (differentiation) ของเซลล์เม็ดเลือดแดงต้นกำเนิด ซึ่งจะมีผลให้เกิดการกระตุ้นการเพิ่มกระบวนการสร้างเม็ดเลือดแดงในเนื้อเยื่อที่เกี่ยวกับการสร้างเม็ดเลือดแดง (hemopoietic tissues) [2] ในนกและสัตว์เลี้ยงลูกด้วยนม รวมถึง มนุษย์ กระบวนการนี้มักจะเกิดขึ้นที่ไขกระดูกแดง (red bone marrow) [2] สำหรับทารกในครรภ์ในช่วงแรก ๆ นั้น การสร้างเม็ดเลือดแดงจะเกิดขึ้นที่ mesodermal cell ของถุงไข่แดง (yolk sac) เมื่ออายุครรภ์ได้ 3-4 เดือน การสร้างเม็ดเลือดแดงจะเปลี่ยนไปอยู่ที่ม้ามและตับ[3] และหลังจาก 7 เดือนไปแล้ว การสร้างเม็ดเลือดแดงจะเปลี่ยนไปอยู่ที่ไขกระดูกแทน กิจกรรมทางกายภาพที่ลดลงสามารถทำให้เกิดการสร้างเม็ดเลือดแดงเพิ่มขึ้นได้[4] อย่างไรก็ตาม ในคนที่เป็นโรคบางอย่างและในสัตว์บางชนิด การสร้างเม็ดเลือดแดงสามารถเกิดขึ้นที่อวัยวะอื่นนอกเหนือจากไขกระดูกได้ เช่น ม้ามและตับ เรียกว่า extramedullary erythropoiesis
ไขกระดูกของกระดูกทั้งหมดจะผลิตเม็ดเลือดแดงจนกระทั่งเด็กอายุได้ 5 ขวบ หลังจากนั้น กระดูกแข้งและกระดูกต้นขาจะเป็นแหล่งหลักในการผลิตเม็ดเลือดแดงจนกระทั่งอายุได้ 25 ปี กระดูกสันหลัง กระดูกสันอก เชิงกรานกระดูกซี่โครง และกระดูกหุ้มสมอง จะทำหน้าที่ผลิตเม็ดเลือดแดงไปตลอดชีวิต
การเปลี่ยนสภาพของเม็ดเลือดแดง
[แก้]สำหรับกระบวนการการเจริญเติบโตของเม็ดเลือดแดง เซลล์จะเข้าสู่การเปลี่ยนสภาพของเซลล์ (cellular differentiation) ขั้นตอนการพัฒนาในขั้นตอนที่ 1-7 เกิดขึ้นภายในไขกระดูก
- hemocytoblast เป็น pluripotent hematopoietic stem cell
- Common myeloid progenitor multipotent stem cell
- unipotent stem cell
- pronormoblast เรียกโดยทั่วไปว่า proerythroblast หรือ rubriblast
- basophilic normoblast/early normoblast เรียกโดยทั่วไปว่า erythroblast
- polychromatophilic normoblast/intermediate normoblast
- orthochromatic normoblast/late normoblast - นิวเคลียสจะถูกไล่ออกก่อนที่จะกลายเป็น reticulocyte
- reticulocyte
เซลล์จะถูกปล่อยจากไขกระดูกเข้าสู่กระแสเลือดหลังจากขั้นตอนที่ 7 โดยจะมี reticulocyte 1% หลังจาก 1-2 วัน เซลล์จะกลายเป็นเม็ดเลือดแดงเต็มวัย (erythrocytes หรือ mature red blood cells) เซลล์ในระยะนี้จะมีลักษณะที่จำเพาะเมื่อย้อมด้วย Wright's stain แล้วส่องด้วยกล้องจุลทรรศน์
ในการพัฒนาของ basophilic pronormoblast ซึ่งเป็นระยะที่เซลล์มีนิวเคลียสขนาดใหญ่และมีปริมาตรถึง 900 fL ไปเป็นเซลล์ที่ปราศจากนิวเคลียสและมีปริมาตรเพียง 95 fL ตามระยะ reticulocyte เซลล์ก็ยังมีความสามารถในการผลิตฮีโมโกลบินอยู่
สิ่งสำคัญสำหรับเม็ดเลือดแดงเต็มวัย คือ วิตามินบี 12 และกรดฟอลิก ถ้าหากขาดแล้วจะทำให้การสร้างเม็ดเลือดล้มเหลวและสามารถแสดงอาการทางคลินิกได้ เช่น reticulocytopenia ซึ่งเป็นภาวะที่เซลล์ reticulocyte มีจำนวนน้อยผิดปกติ
ลักษณะของเม็ดเลือดแดงระหว่างการสร้างเม็ดเลือดแดง
[แก้]เราสามารถเห็นลักษณะการเปลี่ยนแปลงระหว่างการพัฒนาของเม็ดเลือดแดงได้ ดังนี้
- ขนาดของเซลล์จะลดลง
- ปริมาณ cytoplasmic matrix เพิ่มมากขึ้น
- ปฏิกิริยาจากการย้อมสีของไซโตพลาสซึม จะเปลี่ยนจาก basophilic ไปเป็น acidophilic (เนื่องจากการลดลงของ RNA และ DNA)
- ในระยะแรกนั้น นิวเคลียสจะใหญ่และโครมาตินจะหลวม แต่หลังจากการพัฒนาของเซลล์เม็ดเลือดแล้วขนาดของนิวเคลียสจะเล็กลงและจะหายไปพร้อมกับโครมาติน[5]
การควบคุมการสร้างเม็ดเลือดแดง
[แก้]ฮอร์โมน erythropoietin จะช่วยในการควบคุมการสร้างเม็ดเลือดแดง ดังนั้น ในภาวะปกติการสร้างเม็ดเลือดแดงจะสมดุลกับการทำลายเม็ดเลือดแดง และจำนวนเม็ดเลือดแดงก็มีปริมาณเพียงพอกับระดับความต้องการออกซิเจนของเนื้อเยื่อ แต่ไม่มากเหมือนกับที่เกิดจากการรวมตัวกันของเม็ดเลือดแดง (sludging) ภาวะหลอดเลือดมีลิ่มเลือด และโรคหลอดเลือดสมอง ฮอร์โมน Erythropoietin ถูกสร้างขึ้นที่ไตและตับเพื่อตอบสนองต่อภาวะระดับออกซิเจนต่ำ รวมทั้ง Erythropoietin สามารถจับกับเม็ดเลือดแดงที่อยู่ในกระแสเลือดได้ ดังนั้น ถ้าปริมาณเม็ดเลือดแดงในกระแสเลือดต่ำจะทำให้Erythropoietin ที่ไม่สามารถจับได้กับเม็ดเลือดแดงได้มีระดับที่สูงขึ้น ซึ่งจะไปกระตุ้นการสร้างเม็ดเลือดแดงในไขกระดูก
จากการศึกษาเมื่อเร็ว ๆ นี้ พบว่า ฮอร์โมน hepcidin อาจจะมีบทบาทในการควบคุมการสร้างฮีโมโกลบินและอาจส่งผลกระทบต่อการสร้างเม็ดเลือดแดง ฮอร์โมน hepcidin ถูกผลิตขึ้นที่ตับ โดยทำหน้าที่ควบคุมการดูดซึมธาตุเหล็กในระบบทางเดินอาหารและปลดปล่อยธาตุเหล็กจาก reticuloendothelial tissue ธาตุเหล็กสามารถถูกปลดปล่อยออกมาจาก macrophages ในไขกระดูกและจับกับฮีมของฮีโมโกลบินในเม็ดเลือดเแดง
การสูญเสียหน้าที่ของ erythropoietin receptor หรือ JAK2 ในเซลล์หนูนำไปสู่ความล้มเหลวของการสร้างเม็ดเลือดแดง ดังนั้น การสร้างเม็ดเลือดแดงในเอ็มบริโอและการเจริญเติมโตจะได้รับผลกระทบด้วย นอกจากนี้ ถ้าหากไม่มีกระบวนการ feedback inhibition เช่น SOCS (Suppressors of Cytokine Signaling) จะนำไปสู่ภาวะ giantism ในหนู[6][7]
ดูเพิ่ม
[แก้]อ้างอิง
[แก้]- ↑ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc. pp. 123. ISBN 978-0-07-163340-6.
- ↑ 2.0 2.1 2.2 Sherwood, L, Klandorf, H, Yancey, P: Animal Physiology, Brooks/Cole, Cengage Learning, 2005.
- ↑ Palis J, Segel GB (June 1998). "Developmental biology of erythropoiesis". Blood Rev. 12 (2): 106–14. doi:10.1016/S0268-960X(98)90022-4. PMID 9661799.
- ↑ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc. pp. 124. ISBN 978-0-07-163340-6.
- ↑ Textbook of Physiology by Dr. A. K. Jain reprint 2006-2007 3rd edition.
- ↑ Nicolas G, Bennoun M, Porteu A, Mativet S, Beaumont C, Grandchamp B, Sirito M, Sawadogo M, Kahn A, Vaulont S (April 2002). "Severe iron deficiency anemia in transgenic mice expressing liver hepcidin". Proc. Natl. Acad. Sci. U.S.A. 99 (7): 4596–601. Bibcode:2002PNAS...99.4596N. doi:10.1073/pnas.072632499. PMC 123693. PMID 11930010.
- ↑ Michael Föller; Stephan M. Huber; Florian Lang (August 2008). "Erythrocyte programmed cell death". IUBMB Life. 60 (10): 661–668. doi:10.1002/iub.106. PMID 18720418. S2CID 41603762.[ลิงก์เสีย]
